时间:2021-06-11 06:25:06
1、选择题 在常温下,由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
[? ]
① K+、Cl-、NO3-、S2-
② K+、Fe2+、I-、SO42-
③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤ K+、Ba2+、Cl-、NO3-
A.①③
B.③⑤
C.③④
D.②⑤
参考答案:B
本题解析:
本题难度:一般
2、填空题 有一瓶澄清的溶液,其中可能含H+、NH4+、K+、Cu2+、Fe3+、CO32-、I-中的一种或几种,取该溶液进行如下实验:
①用pH试纸检验,表明溶液呈强酸性
②取部分溶液,加入数滴新制的氯水及少量的CCl4,振荡后CCl4层显紫色
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的有?,肯定不存在的离子有?。
(2)不能确定是否存在的离子有_______。证明它(们)是否存在的实验方法是?。
(3)写出步骤②涉及的离子方程式,并用单线桥标出电子转移的方向和数目?。
(4)写出步骤④涉及的离子方程式?。
参考答案:(10分)
(1)H+、I-、NH4+; Cu2+、Fe3+、CO32-
(2)K+、焰色反应
(3)Cl2+ 2I- = I2 + 2Cl-
(4)NH4+ + OH-  ?NH3↑+H2O
?NH3↑+H2O
本题解析:(1)用pH试纸检验,表明溶液呈强酸性,则一定存在H+、一定不存在CO32-;加入数滴新制的氯水及少量的CCl4,振荡后CCl4层显紫色则一定存在I-、另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成,则一定不存在Cu2+、Fe3+;将得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,则一定存在NH4+;
(2)焰色反应能证明是否有K+;
(3)氯气是强的氧化剂,碘离子是强的还原剂,发生反应,生成碘单质;
(4)铵离子在加热的情况下与强酸反应生成氨气。
本题难度:一般
3、选择题 某溶液中加入铝粉,有H2放出,在该溶液中一定能大量共存的离子组是
A.K+、Mg2+、Cl-、SO42-
B.Na+、NH4+、SO42-、HCO3-
C.Na+、K+、SO42-、Cl-
D.K+、Na+、NO3-、AlO2-
参考答案:C
本题解析:
试题解析:加入铝粉能够产生氢气,溶液中可能存在大量的H+或OH-,A.Mg2+与氢氧根离子反应生成难溶物氢氧化镁,在溶液中不能大量共存,故A错误;B.HCO3-能够与H+和OH-发生反应,NH4+与氢氧根离子反应,在溶液中一定不能大量共存,故B错误;C.Na+、K+、SO42-、Cl-离子之间不发生反应,都不与H+和OH-反应,在溶液中能够大量共存,故C正确;D.AlO2-与H+发生反应,NO3-在酸性条件下具有强氧化性,加入铝粉不会生成氢气,故D错误。
考点:离子共存
本题难度:一般
4、选择题 在给定条件的水溶液中一定能大量共存的离子组是
[? ]
A.加入金属铝能产生H2的溶液中:NH4+、Na+、Cl-、AlO2-
B.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
C.澄清透明的无色溶液中:ClO-、MnO4-、Al3+、SO42-
D.含有大量Fe3+的溶液:SCN-、I-、K+、Br-
参考答案:B
本题解析:
本题难度:一般
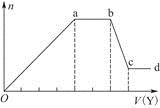
5、填空题 (1)某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | 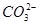 、 、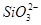 、 、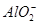 、Cl- 、Cl- |
| 阳离子 | Al3+、Cu2+、Mg2+、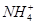 、Na+ 、Na+ |
 Sn(OH)2
Sn(OH)2 Sn2++2OH-。
Sn2++2OH-。参考答案:
(1)①Na+ 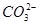 +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
n(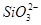 )∶n(
)∶n(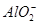 )=11∶2
)=11∶2
②Al(OH)3+OH-=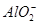 +2H2O
+2H2O
N(Al3+)∶N(Mg2+)∶N(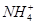 )∶N(Cl-)=2∶1∶4∶12
)∶N(Cl-)=2∶1∶4∶12
(2)①Sn+2H+=Sn2++H2↑
Sn2++Cl2=Sn4++2Cl-
②SnO2 ③NH3·H2O
本题解析:
(1)①若Y为盐酸,则Oa段反应为2H++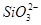 =H2SiO3↓、H++
=H2SiO3↓、H++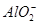 +H2O=Al(OH)3↓,ab段反应为2H++
+H2O=Al(OH)3↓,ab段反应为2H++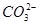 =H2O+CO2↑,bc段反应为Al(OH)3+3H+=Al3++3H2O;X溶液中含有
=H2O+CO2↑,bc段反应为Al(OH)3+3H+=Al3++3H2O;X溶液中含有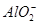 和
和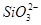 ,故阳离子中只有Na+可以存在;设bc段反应消耗的H+的物质的量为x,则根据bc段反应可得:n(
,故阳离子中只有Na+可以存在;设bc段反应消耗的H+的物质的量为x,则根据bc段反应可得:n(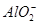 )=
)=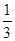 x,根据Oa段反应可得:n(
x,根据Oa段反应可得:n(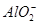 )+2n(
)+2n(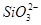 )=4x,解得n(
)=4x,解得n(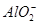 )∶n(
)∶n(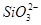 )=2∶11。②若Y为NaOH溶液,则Oa段反应为Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓,ab段反应为
)=2∶11。②若Y为NaOH溶液,则Oa段反应为Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓,ab段反应为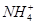 +OH-
+OH- NH3·H2O,bc段反应为Al(OH)3+OH-=
NH3·H2O,bc段反应为Al(OH)3+OH-=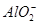 +2H2O;设bc段反应消耗的OH-的物质的量为y,则根据ab段反应可得n(
+2H2O;设bc段反应消耗的OH-的物质的量为y,则根据ab段反应可得n(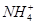 )=2y,根据bc段反应可得n(
)=2y,根据bc段反应可得n(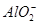 )=y,则根据元素守恒可知n(Al3+)=y,根据Oa段反应可得3n(Al3+)+2n(Mg2+)=4y,解得n(Mg2+)=y,根据电荷守恒可得n(Cl-)=6y,可得:n(Al3+)∶n(Mg2+)∶n(
)=y,则根据元素守恒可知n(Al3+)=y,根据Oa段反应可得3n(Al3+)+2n(Mg2+)=4y,解得n(Mg2+)=y,根据电荷守恒可得n(Cl-)=6y,可得:n(Al3+)∶n(Mg2+)∶n(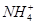 )∶n(Cl-)=2∶1∶4∶12。(2)①Sn的简单阳离子为Sn2+和Sn4+,可迁移铁与盐酸反应,其产物再与氯气反应的离子方程式;②FeCl3溶液蒸干后继续加热所得固体为Fe2O3,故SnCl4溶液蒸干后继续加热所得固体应为SnO2;③由2H++SnO
)∶n(Cl-)=2∶1∶4∶12。(2)①Sn的简单阳离子为Sn2+和Sn4+,可迁移铁与盐酸反应,其产物再与氯气反应的离子方程式;②FeCl3溶液蒸干后继续加热所得固体为Fe2O3,故SnCl4溶液蒸干后继续加热所得固体应为SnO2;③由2H++SnO Sn(OH)2
Sn(OH)2 Sn2++2OH-可知Sn(OH)2具有两性,故应用弱碱NH3·H2O和SnCl2反应制取Sn(OH)2以避免其与强碱反应。
Sn2++2OH-可知Sn(OH)2具有两性,故应用弱碱NH3·H2O和SnCl2反应制取Sn(OH)2以避免其与强碱反应。
本题难度:一般