时间:2021-06-11 06:21:30
1、填空题 (12分)
(1)20℃时0.1 mol·L-1NaOH分别滴定0.1 mol·L-1HCl、0.1 mol·L-1CH3COOH的pH变化曲线如下。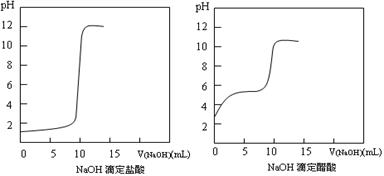
根据上述曲线回答下列问题:
①测得醋酸起点pH为3,则20℃时该浓度醋酸的电离度为 ;
②滴定开始后醋酸曲线变化比盐酸快的原因是 ;
(2)25 ℃时0.1 mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质为 (填化学式)。
(3)下图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。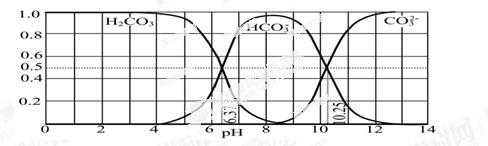
①下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3·H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
2、填空题 (8分)(1)FeCl3的水溶液呈 (“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): 。
(2)实验室在配制 FeCl3的溶液时,常将FeCl3固体先溶于 中,然后再用蒸馏水稀释到所需的浓度。
(3)把FeCl3溶液蒸干,灼烧,最后得到的主要产物是 。
(4)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒中盛碳酸氢钠溶液,其化学反应的原理是(用离子方程式解释) 。碳酸氢钠溶液中的电荷守恒式为 ,溶液中离子浓度由大到小的顺序为 。
3、填空题 (10分)某海域海水一些化学成分如下表
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol·L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |


4、选择题 常温下,0.1 mol/LKCl溶液和0.1 mol/LCH3COOK溶液各100 mL,两溶液中所含离子总数
A.一样多
B.KCl溶液中多
C.CH3COOK溶液中多
D.无法比较
5、选择题 在25℃时,浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2(硫酸亚铁铵)三种溶液中,测得其中c(NH4+)分别为a、b、c(mol/L),则下列判断正确的是
A.a>b>c
B.c>a>b
C.b>a>c
D.a>c>b