时间:2021-06-11 06:17:16
1、选择题 几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是
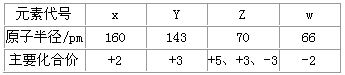
[? ]
 Y
Y参考答案:D
本题解析:
本题难度:简单
2、选择题 化学与科学、技术、社会、环境、生活等密切相关。下列有关说法中错误的是
A.液氨可用作制冷剂
B.小苏打用于治疗胃酸过多
C.明矾可用于自来水的杀菌消毒
D.硅酸钠用于制备硅胶和木材防火剂的原料
参考答案:C
本题解析:明矾投入水中发生水解反应生成氢氧化铝胶体能吸附水中悬浮的固体颗粒物从而达到净水的目的,不是消毒剂,故C项错误。
本题难度:一般
3、推断题 用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种粒子(离子或分子),请回答:
(1)A元素是________、B元素是________、C元素是__________(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式为________?。
(3)E是所有含18个电子的粒子中氧化能力最强的分子,其分子式为__________。
(4)F是由两种元素组成的三原子分子,其分子式是________,电子式是__________。
(5)G分子中含有4个原子,其分子式是__________。
(6)H分子中含有8个原子,其分子式是__________。
参考答案:(1)K、Cl、S
(2)HCl
(3)F2
(4)H2S;
(5)H2O2(或PH3)
(6)C2H6
本题解析:
本题难度:一般
4、选择题 三种短周期元素在周期表中的位置关系如下图所示。下列说法正确的是
[? ]
A.Y的非金属性可能比Z的弱
B.三种元素均为非金属元素
C.Z形成简单离子的半径比Y形成简单离子的半径小
D.Y元素的最高正化合价比Z元素的最高正化合价高
参考答案:B
本题解析:
本题难度:简单
5、选择题 以下关于元素周期表的结构叙述正确的是
[? ]
A.元素周期表有七个主族,八个副族
B.元素周期表有三个长周期(均含18种元素),三个短周期(均含8种元素)
C.第三主族位于元素周期表的第三列(从左往右)
D.零族位于元素周期表的第18列(从左往右)
参考答案:D
本题解析:
本题难度:简单