时间:2021-06-11 06:14:05
1、选择题 利用下图装置(瓶口向上)不可行的实验是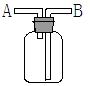

A.A口进气,B口排气,用于收集H2
B.广口瓶中充满水,从A口进气用于收集O2
C.广口瓶中盛有浓硫酸,从B口进气用于干燥SO2气体
D.广口瓶中盛有NaOH水溶液,从B口进气用于除去Cl2中的HCl气体
参考答案:D
本题解析:略
本题难度:一般
2、实验题 某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。
(1)反应过程中末端导管必须始终插入试管A的水中,目的是_____________________。
(2)制备氮化钙的操作步骤是:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后,__________________________________________________________;
④拆除装置,取出产物。
(3)数据记录如下:(假设反应完全)
| 空硬质管质 量m0/g | 硬质管与钙的 质量m1/g | 硬质管与产物 的质量m2/g |
| 14.80 | 15.08 | 15.15 |
参考答案:(1)防止空气中的氧气通过末端导管进入实验装置,氧化单质钙,生成氧化钙,引入杂质?(1分)
(2)熄灭酒精灯,待玻璃管冷却至室温,停止通入氮气,并关闭活塞?(2分)
(3)①2.80 (1分) ②x<3,产物中生成了CaO导致钙的质量分数减小 (2分)
本题解析:(1)由于钙非常活泼需防止空气中的氧气通过末端导管进入实验装置通过末端导管进入实验装置,氧化单质钙,生成氧化钙,引入杂质?
(2)由实验步骤可知应为熄灭酒精灯,待玻璃管冷却至室温,停止通入氮气,并关闭活塞?
(3))m(Ca)=15.08-14.80=0.28g;m(N)=15.15-15.08=0.07g;则 ?="("
?="("  )/(
)/( )解得X=2.80
)解得X=2.80
①2.80 ②若通入的N2中混有少量O2产物中生成了CaO导致钙的质量分数减小,所以x<3。
本题难度:一般
3、实验题 (14分)实验室用固体烧碱配制500mL 1 mol/L的NaOH溶液
(1)(4分)需称量?g的烧碱固体,固体应放在?中称量。
(2)(4分)配制过程中除了烧杯还需要哪些仪器?
?
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低或无影响)(4分)
①定容时俯视刻度线??②容量瓶未干燥?
③转移过程中有少量液体溅出?
④未洗涤烧杯和玻璃棒?
(4)(2分)若定容时液面高于刻度线应采取的措施是?
参考答案:(1)(每空2分)20.0g?小烧杯
(2)(每个1分)托盘天平?玻璃棒? 500ml容量瓶?胶头滴管
(3)(每个1分)偏高?无影响?偏低?偏低
(4)2分?重新配制
本题解析:考查一定物质的量浓度的配制。
(1)根据物质的量浓度的概念可知,需要氢氧化钠的物质的量为0.5L×1mol/L=0.5mol,其质量是0.5mol×40g/mol=20.0g.氢氧化钠易潮解,称量时要放在小烧杯中称量。
(2)称量需要托盘天平,溶解需要玻璃棒,定容需要500ml容量瓶和胶头滴管。
(3)①导致容量瓶中的溶液体积偏小,结果偏高。②不影响。③导致溶质的物质的量减少,结果偏低。④导致溶质的物质的量减少,结果偏低。
(4)定容时液面一旦高于刻度线,则结果偏低,即实验已经失败,需要重新配制。
本题难度:一般
4、实验题 (本题共12分)
氯气和氯乙烯都是重要的化工产品,年产量均在107t左右。氯气的实验室制备和氯乙烯的工业生产都有多种不同方法。
完成下列填空:
(1)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要_________、________(填写试剂或溶液名称)
(2)实验室用2.00mol/L的盐酸和漂粉精[成分为Ca(ClO)2、CaCl2]反应生成氯气、氯化钙和水,若产生2.24L(标准状况)氯气,发生反应的盐酸为_________m,l。
(3)实验室通常用向上排空气法收集氯气。设计一个简单实验,验证所收集的氯气中是否含有空气。
_________________
4)工业上用电石-乙炔法生产乙烯的反应如下:
CaO+3C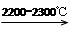 CaC2+CO
CaC2+CO
CaC2+2H2O→HC≡CH↑+Ca(OH)2
HC≡CH↑+HCl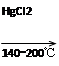 CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖于石油资源。
电石-乙炔法的缺点是___________________、_____________________。
(5)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。设计一种以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
___________________________________
参考答案:(1)饱和氯化钠溶液、氢氧化钠溶液? (2)100
(3)用试管收集氯气,收集满后讲试管倒立在氢氧化钠溶液中,观察试管内有无残留气体。
(4)高能耗?会污染环境
(5)CH2=CH2+Cl2→ClCH2CH2Cl? ClCH2CH2Cl→CH2=CHCl+HCl? HC≡CH+HCl→CH2=CHCl
本题解析:(1)浓盐酸易挥发,生成的氯气中含有氯化氢,应该用饱和氯化钠溶液除去;氯气有毒需要尾气处理,用氢氧化钠溶液吸收。
(2)根据反应物和生成物可知,反应的化学方程式为4HCl+Ca(ClO)2→CaCl2+2H2O+2Cl2↑,反应中生成氯气的物质的量是0.1mol,则消耗氯化氢的物质的量是0.2mol,盐酸的浓度是2.00mol/L,因此需要盐酸的溶液的体积是100ml。
(3)氯气能与氢氧化钠溶液完全反应,而空气与氢氧化钠不反应,据此检验,即试管收集氯气,收集满后讲试管倒立在氢氧化钠溶液中,观察试管内有无残留气体。
(4)根据流程可知,反应需要高温,因此缺点之一是高能耗;需要氯化汞作催化剂,汞是重金属,因此缺点之二是会污染环境。
(5)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢,产生的氯化氢可以与乙炔反应又生成氯乙烯,因此方案为CH2=CH2+Cl2→ClCH2CH2Cl、ClCH2CH2Cl→CH2=CHCl+HCl、HC≡CH+HCl→CH2=CHCl。
本题难度:一般
5、实验题 (15分)氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。工业上通常采用电解法制氯气,其反应原理为:(用化学方程式表示)? ▲?。
某化学兴趣小组欲采用图一装置制取氯气,并探究氯气的性质。
(1)指出图一装置中的错误之处? ▲??,? ▲?
(2)丙装置的作用? ▲?。丙装置中发生反应的离子方程式? ▲?。
(3)为了制得干燥纯净的Cl2,请你结合图二将以上装置重新排序:? ▲?。
(4)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是:
? ▲?。
A.NaBiO3
B.FeCl3
C.PbO2
D.Na2O2
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3
(5)为证明氯气的强氧化性,有同学将图一中的“乙”换成“己”,你认为他这样做对吗?
? ▲?。为什么?? ▲?。
参考答案:(15分)反应原理为:2NaCl + 2H2O  ?2NaOH + H2↑ +Cl2↑(2分)
?2NaOH + H2↑ +Cl2↑(2分)
(1)未用石棉网(1分)?,用长颈漏斗而未用分液漏斗(1分);
(2)吸收多余氯气,防止环境污染(2分)。Cl2+2OH-=Cl-+ClO-+H2O(2分)
(3)甲戊丁乙丙(2分)
(4)? AC (2分,少选给1分,错选不给分)
(5)不对(1分),石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2(2分)
本题解析:略
本题难度:一般