时间:2021-06-11 06:13:44
1、实验题 碱式碳酸铜可表示为:xCuCO3·yCu(OH)2·zH2O,测定碱式碳酸铜组成的方法有多种(Cu
的相对原子质量按63.5计)。
(1)现采用氢气还原法,请回答下列问题:
已知xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式为xCuCO3·yCu(OH)2·zH2O+(x+y)H2 (x+y)Cu+xCO2+(x+2y+z)H2O
(x+y)Cu+xCO2+(x+2y+z)H2O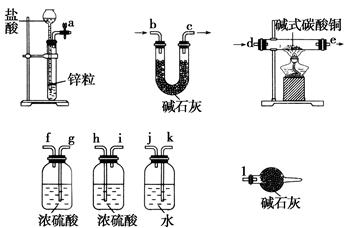
①实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l);
②称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为________g,化学式为________。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由_________________________________________________________
2、选择题 .取含有Fe2O3杂质的铁粉100g,投入过量的盐酸中,产生H2标准状况下31.36L,在反应后的溶液中加入KSCN溶液,没有红色产生,问样品中杂质含量(?)
A? 4%? B? 32%? C? 8%? D? 16%
3、选择题 下列有关实验原理或操作不正确的是( )
A.镀锌铁皮镀锌层厚度的测定:用1:4的硫酸溶液与镀锌铁皮反应,当产生的氢气速率明显减慢时,锌镀层完全反应
B.乙醇与浓硫酸共热至170℃,将制得的气体通入酸性KMnO4溶液来检验制得气体是否为乙烯
C.阿司匹林的提纯是将粗产品先溶解在饱和碳酸氢钠溶液中,过滤后向滤液加入盐酸,冷却后有晶体析出,抽滤并用少量的冷水洗涤晶体
D.用盐酸检验牙膏中的摩擦剂是SiO2、CaCO3、Ca3(PO4)2中的哪一种
4、填空题 某地产孔雀石的主要成分是Cu3(OH)4CO3。
(1)试写出该孔雀石高温分解的化学方程式:_________________________________。
(2)试以(1)中所得金属氧化物为原料,分别采用湿法冶炼和高温冶炼的方式制取金属铜。供选择的试剂有:①木炭②铁屑③生石灰④稀H2SO4,不得另选其他试剂,写出反应的化学方程式。
A.湿法冶炼:___________、___________(可不填满,也可补充。下同)
B.高温冶炼:___________、___________。
5、选择题 向200ml 0.1mol/L的FeCl2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量为
A.1.14g
B.1.6g
C.2.82g
D.4.36g