时间:2021-06-11 06:09:46
1、选择题 现有下列实验用品:烧杯、铁架台(带铁圈)、三角架、分液漏斗、酒精灯、玻璃棒、蒸?发皿和蒸馏烧瓶,从缺少实验用品的角度分析,不能进行的实验项目是(?)
A.过滤
B.蒸发
C.分液
D.萃取
参考答案:A
本题解析:略
本题难度:简单
2、选择题 CuSO4是一种重要的化工原料,有关制备途径及性质如图所示.下列说法错误的是( )
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②<③
D.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol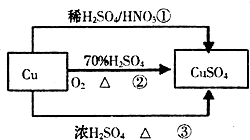
参考答案:A.Cu与混酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,从方程式知,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,所以硝酸为2mol时,硫酸为3mol,用混酸中H2SO4与HNO3物质的量之比最好为3:2,故A正确;
B.相对于途径①、③,途径②的优点:制取等质量胆矾需要的硫酸少、途径2无污染性气体产生,故B正确;
C.生成等量的硫酸铜,三个途径中①②参加反应的硫酸的物质的量相等,而③生成SO2,消耗更多的硫酸,则①=②<③,故C正确;
D.途径②中硫酸只表现为酸性,没有被还原,故D错误.
故选D.
本题解析:
本题难度:一般
3、选择题 下列对比实验,得到的实验结论正确的是( )
| 实验方案 实验结论 实验1 实验2 A 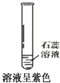 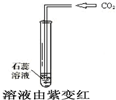 CO2能使紫色石蕊变红 B 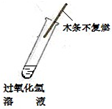 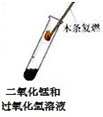 二氧化锰是过氧化氢分解的催化剂 C 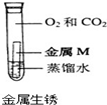 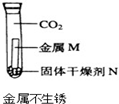 金属M生锈需要氧气 D  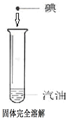 碘在水和汽油中的溶解性不同 | ||
参考答案:A、石蕊试液是酸碱指示剂,二氧化碳是酸性氧化物溶于水生成碳酸,使石蕊试液变红的是碳酸不是二氧化碳,故A错误;
B、带火星的木条迅速复燃,说明了二氧化锰加快了过氧化氢的分解速度;催化剂的作用是加快了反应的速度,并不能使不反应的物质发生反应,故B错误;
C、图示实验说明铁在无水、无氧气状态不易生锈,故C错误;
D、碘在水中和汽油中的溶解性不同,依据相似相溶,碘单质为非极性分子易溶解到非极性溶剂中,而水是极性溶剂,故D正确;
故选D.
本题解析:
本题难度:简单
4、实验题 将无水乙醇逐滴滴入到红热的CuO中,生成的气体通过某白色粉末(装置外边用冰水冷凝)。 实验结果表明:
(I)白色粉末变蓝,并在上边凝有沸点为21℃的无色液体X。
(Ⅱ)X不能与溴水发生加成反应。
(Ⅲ)X能进行卤代反应,一分子X中最多只能有三个H原子被取代,实验测得4. 6g无水乙醇全部反应后, CuO失重1.6g。
(1)根据上述实验数据,可算出每个乙醇脱去的H原子数,从而得出液体X的化学式为__________ 。
(2)根据有机物分子结构理论,把乙醇分子在上述反应中的三种可能脱氢方式(在乙醇的结构式中用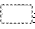 表示脱去的氢原子)和脱氢生成物的结构式填入下表空格中。
表示脱去的氢原子)和脱氢生成物的结构式填入下表空格中。 
(3)在上述三个产物中只有--式是液体X的结构式,请简述另外两式均不合理的原因。 ________________。
参考答案:(1)CH3CHO
(2)
(3)A 因为B式有4个等同的氢,而C式中有C=C与X具有的性质Ⅱ不符
本题解析:
本题难度:一般
5、简答题 将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现.这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出.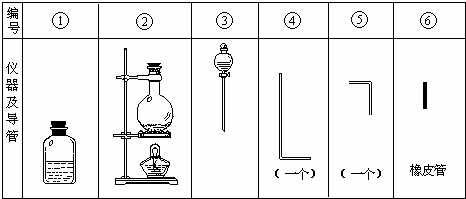
进行此实验,所用的仪器及导管如图.
根据要求填写下列空白:
(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是______.
(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是______.
(3)仪器①的橡皮塞上应有______个孔,原因是______.
(4)实验时,仪器①中除观察到红光外还有______现象.
(5)实验需用约10%H2O2溶液100毫升,现用市售30%(密度近似为1克/厘米3)H2O2来配制,其具体配制方法是______.
(6)实验时仪器①中ClO-与H2O2反应的离子方程式是______.
参考答案:(1)由于反应物是二氧化锰和浓盐酸,所以在反应前二者不能混合,用分液漏斗来装浓盐酸,需要第③装置,反应条件是加热,需要第②个装置,还需要用导管导出氯气,所以用到⑤;
故答案为:③②⑤;
(2)第④中的长导管是将产生的氯气导入第①个装置的,所以需要用橡皮管将长导管与短导管连接起来,所以气体流经的各仪器及导管的编号依次是②⑤⑥④①;
故答案为:②⑤⑥④①;
(3)由于瓶内产生氧气,会使瓶内压强增大,容易将橡皮塞鼓开或发生爆炸,用小孔是为了使瓶内外压强相等;
故答案为:使瓶内外压强相等;
(4)因为有氧气产生所以会产生气泡,故答案为:冒气泡;
(5)溶液稀释溶质不变列等式:x×30%=100毫升×1g/cm3×10% 解得x=33g,33g1g/mL=33mL,再加入水:67毫升
故答案为:用量筒量取33毫升30%(密度近似为1g/cm3)H2O2溶液加入烧杯中,再加入67毫升水,搅拌均匀;
(6)次氯酸根离子有强氧化性,双氧水有还原性,所以次氯酸根离子和双氧水发生氧化还原反应生成氯离子、氧气和水,所以离子方程式为ClO-+H2O2=Cl-+O2↑+H2O,故答案为:ClO-+H2O2=Cl-+O2↑+H2O.
本题解析:
本题难度:一般