时间:2021-06-11 06:05:08
1、选择题 下列电离方程式正确的是(?)
A.NaHSO4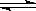 Na++H++SO42一
Na++H++SO42一
B.NaHCO3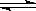 Na++ HCO3一
Na++ HCO3一
C.H2S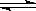 2H++S2-
2H++S2-
D.Mg(OH)2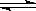 Mg2++2OH-
Mg2++2OH-
参考答案:D
本题解析:用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式。硫酸氢钠、碳酸氢钠是强电解质,应该用等号,AB不正确;H2S是二元弱酸,电离是分步进行的,C不正确,答案选D。
点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大。该题的关键是准确判断出电解质的强弱,然后具体问题、具体分析即可。
本题难度:简单
2、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使甲基橙变红色的溶液中:NO3-、SO42-、Fe2+、Na+
B.强碱性溶液中:NH4+、NO3-、Ba2+、K+
C.澄清透明的溶液中:MnO4-、Al3+、SO42-、K+
D.含大量Fe3+的溶液中:Mg2+、Na+、Cl-、SCN-
参考答案:C
本题解析:试题分析:A、甲基橙的变色范围3.1~4.4,溶液呈酸性,与NO3-构成强氧化性环境,Fe2+易被氧化,错误;B、NH4++OH- NH3↑+H2O,错误;C、此项极易理解错误,有色溶液也可以是透明溶液,错误;D、Fe3+与SCN-易形成Fe(SCN)3络合物,正确。
NH3↑+H2O,错误;C、此项极易理解错误,有色溶液也可以是透明溶液,错误;D、Fe3+与SCN-易形成Fe(SCN)3络合物,正确。
考点:考查离子共存。
本题难度:一般
3、选择题 在含有4 mol HCl和1 mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如右图,下列说法正确的是(? )
A.a→b时的沉淀的成分为BaSO4与Mg(OH)2
B.b→c时发生的离子反应为:H+ + OH— → H2O
C.c→d时离子的物质的量:Ba2+可能大于Cl—
D.d→e时离子的物质的量:Ba2+一定大于OH—
参考答案:B
本题解析:往混合溶液中加Ba(OH)2溶液,开始阶段发生的反应为Ba2++SO42- +2H+ + 2OH— = BaSO4↓+ 2H2O,图像为a-b段;当SO42- 被完全沉淀时,还有2mol H+?,所以继续滴加Ba(OH)2溶液,发生的反应为H+ + OH— = H2O,无沉淀产生,图像为b-c段,该阶段消耗Ba(OH)2 1mol;再继续滴加Ba(OH)2溶液,发生反应为Mg2++ 2OH— = Mg(OH)2↓,所以沉淀有增多,图像为c-d段,当镁离子完全被沉淀,则沉淀不再增多,图像保持d-e段趋势。所以正确的是B,选B。
本题难度:一般
4、选择题 下列哪一种反应不属于取代反应
A.甲烷跟氯气见光
B.溴乙烷跟NaOH乙醇溶液共热
C.苯跟浓硫酸共热
D.2氯丙烷跟KOH水溶液共热
参考答案:B
本题解析:A. 烷烃的取代反应;B. 卤代烃NaOH醇溶液的消去反应;C. 苯的碘化 ( 取代 ) 反应;D. 卤代烃KOH水溶液的水解 ( 取代 ) 反应。
本题难度:一般
5、选择题 Ba(HS)2溶液中加入一定量的CuSO4溶液,发生的反应的离子方程式可能为
A.Ba2++HS-+Cu2++SO42-→BaSO4↓+CuS↓+H+
B.Ba2++2HS-+2Cu2++SO42-→BaSO4↓+2CuS↓+2H+
C.2Ba2++2HS-+Cu2++2SO42-→2BaSO4↓+CuS↓+H2S↑
D.Ba2++2HS-+Cu2++SO42-→BaSO4↓+CuS↓+H2S↑
参考答案:BD
本题解析:分析:反应中HS-离子和Cu2+在溶液中反应生成硫化铜沉淀,促进HS-离子电离,不是HS-离子和Cu2+在溶液中的双水解,依据生成CuS的量不同,分析判断生成产物,所以开始一定生成硫酸钡沉淀;
A、1molBa2+一定含有2molHS-,因为铜离子和硫离子结合会生成难溶于酸的硫化铜沉淀;
B、硫酸铜过量时,HS-离子全部电离生成硫化铜;
C、2molBa2+提供4molHS-,依据2molSO42-溶液中含有2molCu2+,铜离子全部沉淀后剩余HS-会和氢离子形成2molH2S;
D、1molBa2+一定含有2molHS-,1molCu2+ 和1molHS-反应生成1molCuS沉淀,电离出的氢离子和剩余的1molHS-结合生成硫化氢.
解答:A、1molBa2+一定含有2molHS-,因为铜离子和硫离子结合会生成难溶于酸的硫化铜沉淀,故A错误;
B、硫酸铜过量时,HS-离子全部电离生成硫化铜,所以反应的离子方程式为Ba2++2HS-+2Cu2++SO42-=BaSO4↓+2CuS↓+2H+;故B正确;
C、2molBa2+提供4molHS-,依据2molSO42-溶液中含有2molCu2+,铜离子全部沉淀后剩余HS-会和氢离子形成2molH2S,故C错误;
D、1molBa2+一定含有2molHS-,1molCu2+ 和1molHS-反应生成1molCuS沉淀,电离出的氢离子和剩余的1molHS-结合生成硫化氢,反应的离子方程式为:Ba2++2HS-+Cu2++SO42-=BaSO4↓+
CuS↓+H2S↑,故D正确;
故选BD.
点评:本题考查了离子方程式书写方法,主要是量不同产物不同,硫化铜难溶于酸,铜离子促进HS-离子的电离分析是解题关键,题目难度较大.
本题难度:简单