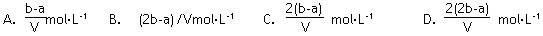时间:2021-06-11 06:05:08
1、选择题 如果NO3-、Fe2+、SO42-、M四种离子以物质的量之比4∶2∶1∶2共存于同一溶液中,那么,M可能是
A.Cl-
B.Na+
C.H+
D.Mg2+
2、选择题 已知M2O7x-+3 S2-+ 14 H+="2" M 3++ 3S↓+7H2O,则M2O7x-中的 M的化合价为(?)
M的化合价为(?)
A.+2
B.+3
C.+4
D.+6
3、选择题 下列说法正确的是?(?)
A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:
4Mg+6H++NO3- =4Mg2++NH4++3H2O
B.25℃时,将20 mL 0.1mol·L-1H2SO4溶液和30 mL 0.15mol·L-1NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11
C.将10 mL 0.1 mol·L-1KAI(SO4)2溶液和10 mL0.2 mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2
D.浓度均为0.1 mol·L-1的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:
c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
4、选择题 等物质的量的CH4和Cl2的混合气体,在光照下使其完全反应,恢复到通常状态时,反应混合物中呈气态的有机物共有
A.一种
B.二种
C.三种
D.四种
5、选择题 把V L含有MgS04和K2S04的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁:另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为