时间:2021-06-11 06:03:21
1、选择题 下列说法中,正确的是( )
A.失去电子的物质是还原剂,具有氧化性
B.氧化还原反应的本质是元素化合价的升降
C.阳离子只有氧化性,阴离子只有还原性
D.氧化还原反应中,某元素由化合态变为游离态,此元素可能被还原也可能被氧化
参考答案:A.失去电子的反应物是还原剂,还原剂具有还原性,在反应中被氧化,故A错误;
B.氧化还原反应的实质是有电子的转移,其特征是有元素化合价的变化,故B错误;
C.阳离子可能有还原性,如亚铁离子,故C错误;
D.氧化还原反应中,某元素由化合态变为游离态,根据元素化合价变化判断被氧化还是被还原,如果失电子则被氧化,如果得电子则被还原,故D正确;
故选D.
本题解析:
本题难度:一般
2、选择题 下列叙述中,正确的是( )
A.含金属元素的离子一定都是阳离子
B.在氧化还原反应中,非金属一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
参考答案:举出反例,即可判断选项的对错.
A、AlO2-离子中含金属元素,故A选项错误;
B、氢气还原氧化铜的反应中,氢气作还原剂,氧化铜作氧化剂,故B选项错误;
C、在反应2H2S+SO2═3S+2H2O中,硫元素从化合态变为游离态时,该元素既被还原又被氧化,故C选项错误;
D、Fe3+可被还原为Fe2+,故D选项正确.
故选D.
本题解析:
本题难度:一般
3、填空题 某反应体系中的物质有KMnO4、FeSO4、H2SO4、Fe2(SO4)3、MnSO4、K2SO4、H2O
(1)请将除水之外的反应物、产物填入以下横线中
______+______+______------______+______+______+H2O
(2)反应中,被氧化的元素是______,氧化剂是______,还原产物是______
(3)将氧化剂和还原剂填入空格中,并标出电子转移的方向和数目
参考答案:(1)高锰酸钾有强氧化性,所以选高锰酸钾作氧化剂,FeSO4中Fe元素的化合价为+2价,Fe2(SO4)3中Fe元素的化合价为+3价,要选择失电子的物质作还原剂,所以选,FeSO4作还原剂,由高锰酸钾生成硫酸锰需硫酸参加反应,根据反应前后元素守恒,水在生成物中;故答案为:MnSO4 FeSO4 H2SO4 MnSO4 Fe2(SO4)3 K2SO4;
(2)反应中被氧化的是化合价升高的铁元素,氧化剂为化合价减低的高锰酸钾,氧化剂被还原为MnSO4;
故答案为:铁;KMnO4;MnSO4;
(3)该反应中化合价的变化为:KMnO4→MnSO4,Mn元素由+7价→+2价,一个KMnO4分子得5个电子做氧化剂;FeSO4→Fe2(SO4)3,Fe元素由+2价→+3价,一个FeSO4失去1个电子,做还原剂;依据得失电子的最小公倍数为5,所以KMnO4的计量数为1,FeSO4的计量数为5,即氧化剂和还原剂的定量关系为:2KMnO4+10FeSO4;依据化合价变化和电子守恒得到电子转移为10e-;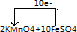
?故答案为:氧化剂:KMnO4;还原剂:FeSO4;
电子转移为: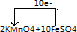
.
本题解析:
本题难度:一般
4、选择题 化学概念是对化学现象与事实的总结和概括.下列说法中正确的是( )
A.分散系只包括溶液和胶体
B.使空气中游离态的氮转化为含氮化合物叫做氮的固定,氨的合成即为固氮
C.单位物质的量的物质所具有的质量叫摩尔质量,摩尔质量与1mol物质的质量完全相同
D.物质失电子的反应为还原反应
参考答案:A、分散系包括胶体、浊液、溶液,故A错误;
B、使空气中游离态的氮转化为含氮化合物叫做氮的固定.如氨的合成即为固氮,故B正确;
C、摩尔质量的单位是g/mol,质量的单位是g,摩尔质量与1mol物质的质量在数值上相等,故C错误;
D、物质失电子的反应为氧化反应,物质得电子的反应为还原反应,故D错误.
故选B.
本题解析:
本题难度:简单
5、选择题 下列变化需要加入氧化剂才能实现的是( )
A.HCl→H2
B.NaCl→Cl2
C.CuSO4→Cu
D.HClO→O2
参考答案:B
本题解析:解析:A.HCl→H2中,H元素的化合价降低,需要加还原剂实现,故A不选;
B.NaCl→Cl2中,Cl元素的化合价升高,需要加氧化剂实现,故B选;
C.CuSO4→Cu中,Cu元素的化合价降低,需要加还原剂实现,故C不选;
D.HClO→O2中,O元素的化合价升高,但HClO分解可实现,故D不选;
所以答案选B
本题难度:简单