时间:2021-06-11 06:02:59
1、选择题 下列数值等于阿伏加德罗常数的是()
A.1 mol Fe2+还原成单质需结合的电子数
B.1 mol He含有的原子数
C.1 mol He含有的质子数
D.1 mol H2中含有的电子数
参考答案:B
本题解析:1 mol Fe2+还原成Fe需结合2 mol e?,即2NA个,A选项错误;He是单原子分子,故1 mol He中含有的原子数是1 mol,即NA个,B选项正确;1个He原子中含2个质子,1 mol He含有的质子数为2NA,C选项错误;1个H2分子中含2个e-,1 mol H2中含2NA个e-,D选项错误。
本题难度:简单
2、选择题 1 mol Na2O2与2 mol NaHCO3固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A.Na2CO3
B.Na2O2、Na2CO3
C.NaOH、Na2CO3
D.Na2O2、NaOH、Na2CO3
参考答案:A
本题解析:由题可知,该过程发生的反应为:2NaHCO3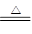 Na2CO3+H2O+CO2↑,
Na2CO3+H2O+CO2↑,
2Na2O2+2CO2=2Na2CO3+O2↑,2Na2O2+2H2O=4NaOH+O2↑,2 mol NaHCO3固体反应生成了1mol水和1mol二氧化碳,所以而生成的二氧化碳刚好与过氧化钠反应,而不与水反应,因为水加热被蒸发了,所以残留的固体物质是Na2CO3 ,故本题的答案选择A。
考点:钠及其化合物
点评:本题考查了钠及其化合物,该知识点是高考考查的重点和难度,本题比较抽象,有一定的难度。
本题难度:一般
3、选择题 下列关于0.05mol /L的K2SO4溶液的说法中,正确的是
A.1L溶液中含有K+、SO42-总数为0.03NA
B.1L溶液中含有K+数目是0.1NA
C.1 L溶液中K+的浓度是0.20 mol / L
D.2 L溶液中含有SO42-的浓度是0.3mol / L
参考答案:B
本题解析:在0.05mol /L的K2SO4溶液中K+的浓度是0.10 mol / L、SO42-的浓度是0.05mol / L,而与溶液体积无关,排除CD选项;在1L的0.05mol /L的K2SO4溶液中,K+数目为0.05×2×1×NA=0.1NA,SO42-个数为0.05NA,两者总数为0.15NA,故答案为B
本题难度:一般
4、选择题 设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.lmolO2含有的电子数为17NA
B.电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2NA
C.常温常压下,32g
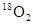 中所含的中子数为20NA
中所含的中子数为20NA
D.工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜小于0.5 NA
参考答案:D
本题解析:氧原子的核外电子数是8个,所以1mol氧气含有16mol电子,选项A不正确;电解饱和食盐水时,阳极上生成氯气,但22.4L气体不一定是在标准状况下,所以选项B不正确;32g
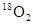 中所含的中子的物质的量是
中所含的中子的物质的量是 ,选项C不正确,所以正确的答案选D。
,选项C不正确,所以正确的答案选D。
本题难度:简单
5、填空题 (1) 3.01×1024个OH-的物质的量为 ___ ,质量为 _______ ,这些OH-与标准状况下 L NH3的物质的量相等,如果这些OH-自2L的Ba(OH)2溶液,则该Ba(OH)2的物质的量浓度为 。
(2)同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的质量之比为_________ ____,所含电子数之比为____________,相同质量的氨气和硫化氢气体的分子数之比为__________密度之比为______________,。
参考答案:(每空1分)
(1) 5mol 85g 112 1.25mol/L (2)1:2 , 5:9 , 2:1 ,1:2
本题解析:(1)3.01×1024个OH-的物质的量为:n(OH?)= 3.01×1024÷6.02×1023mol-1=5mol;质量为m(OH?)=5mol×17g/mol=85g;V(NH3)=5mol×22.4L/mol=112L;n[Ba(OH)2]=1/2n(OH?)=1/2×5mol=2.5mol,则c【Ba(OH)2】=2.5mol÷2L=1.25mol?L?1。
(2)同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的物质的量相等,则质量之比等于摩尔质量之比为17:34=1:2;NH3分子含有10个电子,H2S分子含有18个电子,则所含电子数之比为10:18=5:9;相同质量的氨气和硫化氢气体的分子数之比等于物质的量之比,1/17:1/34=2:1;密度之比等于摩尔质量之比17:34=1:2。
考点:本题考查物质的量的相关计算、阿伏加德罗定律及其推论。
本题难度:一般