时间:2021-06-11 05:55:26
1、计算题 23.(10分)(1)一种气态烷烃和一种气态烯烃的混合物10g,其密度是相同条件下氢气密度的12.5倍,当此混合气体通过足量溴水时,溴水质量增重8.4 g,则这两种烃分别为?,?;体积比?
(2)0.1mol某烃完全燃烧,生成10.8g H2O和11.2LCO2(标准状况下)。则该烃的分子式:?;在其同分异构体中,一氯代物只有一种的结构简式是:?
(3)往一容积为10 L的密闭容器中充入2 mol N2、4 mol H2进行合成氨反应N2+3H2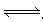 2NH3。5 min后达到平衡,该合成反应5 min内的速率v(NH3)=" 0.02" mol/(L·min)。试求平衡时,容器中N2转化率是?。
2NH3。5 min后达到平衡,该合成反应5 min内的速率v(NH3)=" 0.02" mol/(L·min)。试求平衡时,容器中N2转化率是?。
参考答案:(1)CH4,C2H4;1:3?(2)? C5H12?;?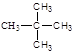 ?(3)25%
?(3)25%
本题解析:(1)密度是相同条件下氢气密度的12.5倍,则其相对分子质量是12.5×2=25。由于比25小的烃只有甲烷,因此烷烃是甲烷。甲烷和溴水不反应,所以溴水增加的质量就是烯烃的质量,即烯烃是8.4g,甲烷是1.6g,物质的量是0.1mol。混合气的物质的量是10g÷25g/mol=0.4mol,所以烯烃的物质的量是0.3mol,其相对分子质量是8.4÷0.3=28,即烯烃是乙烯,甲烷和乙烯的体积之比是1︰3.
(2)10.8g H2O和11.2LCO2(标准状况下)的物质的量分别是0.6mol和0.5mol。所以根据原子守恒可知,该烃的分子式为C5H12。在其同分异构体中,一氯代物只有一种的是新戊烷,正戊烷是3种,异戊烷是4种。新戊烷的结构简式为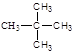 。
。
本题难度:一般
2、选择题 图为一带可移动隔板的密闭容器,某温度下,左、右两侧反应均达平衡,此时隔板处于容器中央。若保持温度不变,向左侧容器中充入一定量的H2,下列说法正确的是 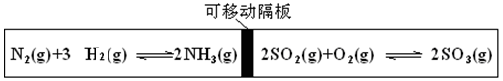
A.两侧平衡均向正反应方向移动
B.左侧平衡向逆反应方向移动
C.右侧平衡向逆反应方向移动
D.两侧平衡均向逆反应方向移动
参考答案:A
本题解析:
向左侧容器中充入一定量的H2,左侧的平衡向正反应方向移动,但左侧压强比原来大了;对于右侧来说,压强也增大了,平衡向正反应方向移动。故两侧平衡均向正反应方向移动,选A。
本题难度:一般
3、选择题 用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g) CH3OH(g) △H<0
CH3OH(g) △H<0
按照相同的物质的量投料,测的CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是(? )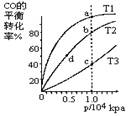
A.平衡常数:K(a)>K(c) K(b)=K(d)
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平均摩尔质量:M(a)<M(c) M(b)>M(d)
D.平衡时a点一定有n(CO):n(H2)=1:2
参考答案:A
本题解析:该反应的正反应是个气体体积减小的放热反应。化学平衡向吸热方向移动。即化学平衡向逆反应方向移动。这时反应物的转化率降低。由图可看出:T3>T2> T1。所以Ka >Kb> Kc.化学平衡常数只与温度有关,而与压强等无关。所以K(b)=K(d)。A正确。升高温度,不论是正反应速率还是逆反应速率都加快。故正反应速率:v(c) >v (a);在相同温度下,增大压强反应混合物的浓度增大,反应速率加快,由于压强b>d v(b) > v(d)。B错误。C.在相同压强下,温度升高,化学平衡向逆反应方向移动。,由于反应前后质量不变,但气体的物质的量增多故。平均摩尔质量:M(c)<M(a)在相同温度下,增大压强,化学平衡向气体体积减下的方向,即正反应方向移动, M(b)>M(d)。所以C错误。D.反应时CO、H2是按照1:2反应的,所以平衡时a点可能有n(CO):n(H2)=1:2,也可能不是。错误。
本题难度:一般
4、简答题 设在某温度时,在容积为1L的密闭容器内,把氮气和氢气两种气体混合,反应后生成氨气.实验测得,当达到平衡时,测得氮气和氢气的浓度各为2mol/L,该温度下的平衡常数为0.5625则
(1)平衡时氨气的浓度为______
(2)求起始加入氮气的浓度
(3)反应前混合气体的平均分子量.
参考答案:达到平衡时,测得氮气和氢气的浓度各为2mol/L,该温度下的平衡常数为0.5625,
(1)根据平衡常数表达式k=c2(NH3)c(N2)?c3(H2)可知,c2(NH3)2×2=0.5625,解得c(NH3)=1.5mol/L,
故答案为:1.5mol/L;
(2)根据N2+3H2?2NH3,可知氮气的浓度变化量为1.5mol/L×12=0.75mol/L,故氮气的起始浓度为2mol/L+0.75mol/L=2.75mol/L,
答:氮气的起始浓度为2.75mol/L.
(3)根据N2+3H2?2NH3,可知氢气的浓度变化量为1.5mol/L×32=2.25mol/L,故氮气的起始浓度为2mol/L+2.25mol/L=4.25mol/L,
故反应前混合气体中氮气与氢气的物质的量之比为2.75mol/L:4.25mol/L=11:17,故反应前混合气体的平均相对分子质量为11×14+17×211+17=6.7,
答:反应前混合气体的平均相对分子质量为6.7.
本题解析:
本题难度:一般
5、选择题 下列反应中可判断为可逆反应的是( )
A.氢气和氯气点燃生成氯化氢,氯化氢受热分解为氢气和氯气
B.氮气和氢气在高温、高压、催化剂作用下可以生成氨气,同时氨气又分解为氮气和氢气
C.单质溴可以置换出碘,氯气又可以置换出溴
D.氯气和水反应生成盐酸和次氯酸,次氯酸光照条件下可分解为盐酸和氧气
参考答案:B
本题解析:可逆反应是在在相同条件下,既能向正反应方向进行,又能向逆反应方向进行的反应是可逆反应,所以只有选项B是正确的。答案选B。
本题难度:一般