时间:2021-06-11 05:55:26
1、填空题 黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe2O3。
(1)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,反应:
2SO2(g)+O2(g)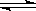 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。计算该条件下反应的平衡常数K和SO2的平衡转化率??、??。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。计算该条件下反应的平衡常数K和SO2的平衡转化率??、??。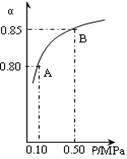
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有??(填字母序号,多选倒扣分)。
A.升高温度?B.降低温度
C.增大压强?D.加入催化剂
E.移出氧气
(3)某温度下,上述反应中SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。判断:平衡状态由A变到B时,平衡常数K(A)______K(B)(填“>”、“<”或“=”)。
参考答案:(1)1.6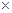 103?80%?
103?80%?
(2)B C
(3)=
本题解析: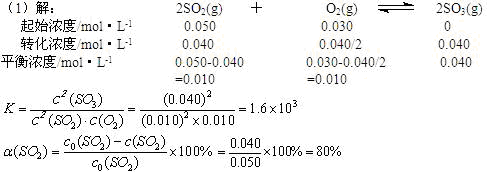
(2)该反应为放热反应,所以降低温度有利于提高SO2平衡转化率,又由于左边系数之和大于右边,所以增大压强也有利于提高SO2平衡转化率,加入催化剂不能提高SO2平衡转化率,移出氧气降低了SO2平衡转化率。故答案为B C。
(3)温度不变,平衡常数不变,所以K(A)=K(B)
点评:该题考查化学平衡的移动,是高考的考查重点,该题的信息量不大,也相对比较容易。
本题难度:一般
2、选择题 对于平衡体系,mA(气)+ nB(气) pC(气)+qD(气)+ Q有下列判断,其中正确的是?
pC(气)+qD(气)+ Q有下列判断,其中正确的是?
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+ n> p+ q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若平衡体系共有气体a mol,再向其中加入b mol B,当重新达到平衡时,气体的总物质的量等于(a+b),则m+n=p+q
D.温度不变时,若压强增大至原来的2倍,达到新平衡时,
参考答案:B、C
本题解析:A中体积增大1倍,则压强变为原来的1/2,A的浓度变为原来的0.48倍,A的浓度减小了,故平衡向正反应方向移动了,证明正反应是一个气体体积增大的反应,即m+n<p+q。
量之比等于方程式中系数比,故起始反应物的物质的量之比也应等于系数比。
C中向平衡体系中加入b mol B,重新达平衡时,气体物质的量没变仍为(a+b)mol,证明该反应是一个等体积的反应,即(m+n)=p+q。
D中若m+n= p+q,则当压强增大到原来的2倍时,达平衡时的总体积刚好为原体积的 1/2。故 A、D的说法是错误的,B、C是正确的。
本题难度:一般
3、选择题 下列叙述中,不正确的是( )
A.某特定反应的平衡常数仅是温度的函数
B.催化剂不能改变平衡常数的大小
C.平衡常数发生变化,化学平衡必定发生移动,达到新的平衡
D.化学平衡发生移动,平衡常数必发生变化
参考答案:D
本题解析:平衡常数与温度有关系,A正确;催化剂只能改变反应速率,但不能改变平衡状态,所以不能改变平衡常数,B正确;平衡常数发生变化,化学平衡必定发生移动,达到新的平衡,但化学平衡发生移动,平衡常数不一定生变化,C正确,D不正确,答案选D。
点评:该题是高考中的常见题型和重要的考点,主要是考查学生对平衡常数黑烟、影响因素以及与化学平衡移动的关系裂解掌握情况,有利于提高学生的应试能力,提升学生的学科素养。
本题难度:一般
4、填空题 (共12分) 现有反应:mA(g)+nB(g)? pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为__________热反应,且m+n________p(填“>”、“=”或“<”)。
(2)减压时,A的质量分数________(填“增大”、“减小”或“不变”,下同)。
(3)若加入催化剂,平衡时气体混合物的总物质的量
________________________________________________________________________。
(4)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色________;而维持
容器内压强不变,充入氖气时,混合物颜色________(填“变深”、“变浅”或“不变”)。
参考答案:(1)放 > (2)增大 (3)不变 (4)变深 变浅
本题解析:升高温度,B的转化率变大,说明平衡向正反应方向移动,即正反应是吸热反应。当减小压强时,混合体系中C的质量分数减小,说明平衡向逆反应方向移动,因此正反应是体积减小的反应,即m+n大于p。减压时,平衡向逆反应方向移动,所以A的质量分数增大。催化剂不能改变平衡状态,所以平衡时气体混合物的总物质的量不变。加入C(体积不变)时,生成物B的浓度会增大,所以颜色变深。维持容器内压强不变,充入氖气时,容器体积一定要变大,B的浓度一定要降低,所以颜色会变浅。
本题难度:简单
5、简答题 已知可逆反应:CO(g)+H2O(g)?CO2(g)+H2(s);,在某温度下,反应物的起始浓度分别为:c(CO)=1mol/L,c(H2O)=2.4mol/L;达到平衡后,CO的转化率为60%.
(1)求此时H2O的转化率为______,该温度下反应的平衡常数为______.
(2)若反应温度不变,反应物的起始浓度分别为:c(CO)=4mol/L,c(H2O)=amol/L;达到平衡后c(CO2)═2mol/L,求a的数值为______.
参考答案:(1)达到平衡后,CO的转化率为60%,则CO的浓度变化量=1mol/L×60%=0.6mol/L,则;
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol/L):1 2.40 0
变化(mol/L):0.6 0.60.3 0.3
平衡(mol/L):0.4 1.8 0.6 0.6
故此时H2O的转化率=0.6mol/L2.4mol/L×100%=25%,
平衡常数k=0.6×0.60.4×1.8=0.5,
故答案为:25%;0.5;
(2)达到平衡后c(CO2)═2mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol/L):4a0 0
变化(mol/L):2 22 2
平衡(mol/L):2 a-222
故2×22×(a-2)=0.5,解得a=6
故答案为:6.
本题解析:
本题难度:一般