时间:2021-06-11 05:54:23
1、选择题 将0.1molCu与40ml 10mol/LHNO3充分反应,测得反应后溶液里含有amol H+由此可知:
A.生成的气体一定是NO2,在标准状况下的体积4.48 L
B.生成的气体一定是NO,在标准状况下的体积约1.49 L
C.被还原的硝酸的物质的量为(0.2-a)mol
D.反应后的溶液里含有0.2mol NO3-
参考答案:C
本题解析:由题意知硝酸过量,反应后溶液中溶质是硝酸铜和硝酸,由电荷守恒得:2n(Cu2+)+n(H+)=n(NO3-),n(NO3-)=(0.2+a)mol,D正确;所以被还原的硝酸物质的量为0.4mol-(0.2+a)mol=(0.2-a)mol,C正确;10mol/LHNO3为浓硝酸,随着反应进行硝酸由浓变稀,所以生成的气体为二氧化氮和一氧化氮的混合物,设二氧化氮和一氧化氮气体物质的量分别为xmol、ymol。由得失电子相等得x+3y=0.2,被还原硝酸物质的量即为二氧化氮气体和一氧化氮气体物质的量总和,x+y=0.2-a,解得x=(0.2-1.5a)、y=0.5a,A、B错误。
点评:硝酸与金属的反应要抓住两个守恒:得失电子守恒和氮原子守恒。
本题难度:一般
2、选择题 NA为阿伏加德罗常数,对于1mol/L的硫酸溶液,下列叙述错误的是 (? )
A.1000mL溶液中,含2NA个H+
B.1000mL溶液中,含3NA个离子(H+、SO42-)
C.1000mL溶液中,加入足量Zn,可生成2NA个H2分子
D.1000mL溶液中,加入足量Zn,可生成NA个Zn2+
参考答案:C
本题解析:略
本题难度:简单
3、选择题 0.5 L 1 mol/L FeCl3溶液与3 L 0.5 mol/L KCl溶液中的Cl-的数目之比
A.1:6
B.1:1
C.2:1
D.3:1
参考答案:B
本题解析:0.5 L 1 mol/L FeCl3溶液中Cl-浓度为1.5mol/L,其中Cl-的数目为1.5NA;3 L 0.5 mol/L KCl溶液中的Cl-浓度为0.5 mol/L KCl,其中Cl-的数目为1.5NA;故B正确。
考点:了解溶液的组成。理解溶液中溶质的质量分数的概念,并能进行有关计算。
点评:本题考查溶液溶质粒子的“量”的求算方法,注重基础知识的灵活应用。
本题难度:一般
4、计算题 (4分)将5.6克铁投入足量的硫酸铜溶液中充分反应,求生成硫酸亚铁的物质的量和生成铜的质量?
参考答案: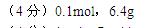
本题解析:略
本题难度:简单
5、选择题 用NA表示阿伏加德罗常数。下列说法正确的是
A.12 g NaHSO4固体中含有的离子数为0.3 NA
B.足量Cl2与5.6 g Fe完全反应时,转移的电子数为0.2 NA
C.标准状况下,0.56 L 丙烷中含有的共价键数为0.25 NA
D.电解精炼铜时每转移NA个电子,阳极溶解32 g铜
参考答案:C
本题解析:A、NaHSO4固体中存在的离子是Na+和HSO4-,12 g NaHSO4固体的物质的量是0.1mol,所以含有的离子数为0.2 NA,错误;B、5.6g的Fe的物质的量是0.1mol,与氯气反应生成+3价铁离子,所以转移的电子数为0.3NA,错误;C、标准状况下,0.56 L 丙烷的物质的量是0.025mol,1个丙烷中的共价键数目是10,所以0.025mol的丙烷中的共价键数为0.25 NA,正确;D、粗铜中含有铁、锌等杂质,先于铜失电子进入溶液,所以每转移NA个电子,阳极溶解铜的质量小于32g,错误,答案选C。
本题难度:一般