时间:2021-06-11 05:50:25
1、实验题 (2014届山东省烟台市高三3月模拟化学试卷)
硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5?H2O,硼砂的化学式为Na2B4O7?10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为: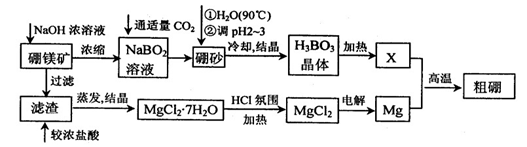
回答下列有关问题:
(1)硼砂中B的化合价为?,溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为?。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为?。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是?。若用惰性电极电解MgCl2溶液,其阴极反应式为 ?。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为??。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为??。已知Ksp[Mg(OH)2]=5.6 10-12,当溶液pH=6时??(填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时??(填“有”或“没有”)Mg(OH)2沉淀析出。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将? 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1 Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为?滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 ?。(提示:I2+2S2O32-=2I-+S4O62-)
参考答案:(1)+3(2分) B4O72-+2H++5H2O= 4H3BO3(2分)Mg+B2O3===2B+3MgO(2分)?
(2)防止MgCl2水解生成Mg(OH)2(2分)?
2H2O+Mg2++2e-= H2↑+Mg(OH)2↓(2分)
(3)H2O2+2H++2e-=2H2O(2分)? 0.045 mol·L-1(2分)?没有(2分)
(4)碱式(2分)? 99%(2分)
本题解析:
(1)根据硼砂的化学式Na2B4O7?10H2O和化合价的代数和为0,可得B的化合价为+3;B4O72-与2H+反应可得H3BO3,离子方程式为:B4O72-+2H++5H2O= 4H3BO3;X为H3BO3晶体加热脱水的产物,为B2O3,与Mg发生氧化还原反应,化学方程式为:Mg+B2O3===2B+3MgO。
(2)MgCl2为强酸弱碱盐,能发生水解反应,所以MgCl2·7H2O在HCl氛围中加热的目的是:防止MgCl2水解生成Mg(OH)2;用惰性电极电解MgCl2溶液,阴极反应为H2O电离出的H+放电,电解方程式为:2H2O+Mg2++2e-= H2↑+Mg(OH)2↓
(3)镁-H2O2酸性燃料电池的正极为H2O2放电,电极方程式为:H2O2+2H++2e-=2H2O;起始电解质溶液pH=1,pH=2时反应的H+为:0.1mol?L?1—0.01mol?L?1=0.09mol?L?1,根据Mg+H2O2+2H+==Mg2++2H2O,可得Mg2+离子浓度为0.045 mol·L-1;溶液pH=6时,c(OH?)=10-8mol?L?1,Q [Mg(OH)2]=" 0.045" mol·L-1×[10-8mol?L?1]2=4.5×10-18 < Ksp[Mg(OH)2],所以没有Mg(OH)2沉淀析出。
(4)Na2S2O3为强碱弱酸盐,水解显碱性,所以Na2S2O3溶液应盛放在碱式滴定管内;根据元素守恒和离子方程式可得:2B ~ 2BI3 ~ 3I2 ~ 6 S2O32-,所以粗硼样品的纯度为:0.018L×0.30mol?L?1×1/3×11g/mol÷×100% = 99%
本题难度:一般
2、填空题 (2分)由铜、银和硝酸银溶液组成的原电池中,负极反应式为 ,正极反应式为 。
参考答案:(2分)负极:Cu-2e— ="=" Cu2+ 正极:2Ag++2e— ="=" 2Ag
本题解析:略
本题难度:一般
3、选择题 把a、b、c、d四块金属浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b上有大量气泡产生,则四种金属的活动性由强到弱的顺序是
A. a>b>c>d B a>c>d>b C. c>a>b>d D. b>d>c>a
参考答案:B
本题解析:考查原电池的应用。在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以正确的答案是B。
本题难度:一般
4、选择题 下列叙述正确的是 ( )
A.在pH=1的溶液中Na+、NH4+、[Al(OH)4]-、SO42-可以大量共存
B.1 L 0.1 mol·L-1乙酸溶液中H+数为0.1NA,NA为阿伏加德罗常数
C.在铁制管道上连接一锌块利用了牺牲阳极保护法
D.生活中可以使用明矾对饮用水进行杀菌消毒
参考答案:C
本题解析:A错,pH=1的溶液隐含了H+,在酸性溶液中[Al(OH)4]-不能共存;B错,乙酸为弱酸不能全部电离;C正确,在铁制管道上连接一锌块形成了原电池,属于牺牲阳极的阴极保护法;D错,明矾只能净水,无强氧化性,不能杀菌消毒。
本题难度:一般
5、选择题 如图装置中,在U形管底部盛有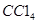 ,分别在U形管两端小心倒入饱和食盐水和饱和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述错误的是
,分别在U形管两端小心倒入饱和食盐水和饱和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述错误的是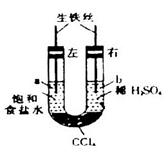
A.铁丝在两处的腐蚀速率: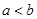
B.a、b两处相同的电极反应式为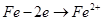
C.一段时间后,a处液面高于b处液面
D.生铁丝中的碳在a、b两处分别作原电池的负极和正极
参考答案:D
本题解析:生铁和氯化钠溶液、稀硫酸溶液都能构成原电池,左边试管中,生铁发生吸氧腐蚀,右边试管中,生铁发生析氢腐蚀。A、生铁发生析氢腐蚀的速率比吸氧腐蚀的速率大,正确;B、a处负极上铁失电子,正极上氧气得电子,b处负极上铁失电子,正极上氢离子得电子,所以a、b两处相同的电极反应式为Fe-2e-=Fe2+,正确;C、a处发生吸氧腐蚀,b处发生析氢腐蚀,一段时间后,a处气体压强减小,b处气体压强增大,导致溶液从b处向a处移动,所以a处液面高于b处液面,正确;D、生铁中的碳在a、b两处都作正极,错误。
本题难度:一般