时间:2021-06-11 05:49:43
1、选择题 下列说法正确的是
A.将明矾加入海水中静置过滤是海水淡化的方法之一
B.海水晒盐的过程发生复分解反应
C.海水中提取镁的过程不涉及氧化还原反应
D.从海水中提取铀等微量元素是海水资源综合利用研究方向之一
2、选择题 工业上要冶炼金属钠,可使用的方法是(?)
A.电解法
B.加热分解法
C.还原剂加热法
D.铝热剂法
3、选择题 在制取水泥、玻璃的生产中,共同使用的主要原料是
[? ]
A.Na2CO3
B.石灰石
C.石英
D.黏土
4、判断题 (10分)A是一种可以作为药物的有机化合物。请从下列反应图式中各有机物的关系(所有无机物均已略去),推测有机物A、B、C、E、F的结构简式。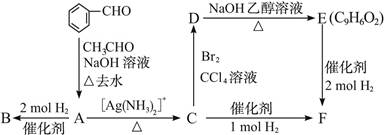
5、选择题 随着世界人口的急剧增长、工业的蓬勃发展,淡水供应危机日益成为世界关注的焦点,海水约占地球现有总水量的97%,海水淡化问题已成为科学家的主要研究方向,若实行海水淡化来供应饮用水,下列方法在原理上完全不可行的是( )
A.加入明矾,使海水的盐分沉淀并淡化
B.利用太阳能,将海水蒸馏淡化
C.将海水通过离子交换树脂,以除去所含的盐分
D.利用半透膜,采用反渗透法而使海水淡化