时间:2021-06-11 05:47:56
1、填空题 (4分)对于反应:N2(g)+3H2(g) 2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)能使正反应速率瞬时加快的因素有____________(填字母,下同);
(2)能使逆反应速率瞬时加快的因素有____________
A.增大N2和H2的浓度
B.增大压强
C.升高温度
D.加(正)催化剂
E.增加NH3浓度
F.减少NH3浓度
参考答案:(1)ABCD (2)BCDE
本题解析:对于反应:N2(g)+3H2(g)  2NH3(g) ΔH<0可知A.增大N2和H2的浓度是瞬间增大了正反应速率,逆反应速率不变;B.增大压强、C.升高温度、D.加(正)催化剂均可瞬间同时增大正、逆反应速率;E.增加NH3浓度是瞬间增大了逆反应速率,正反应速率不变;故使正反应速率瞬间增大的条件有:A.增大N2和H2的浓度、B.增大压强、C.升高温度、D.加(正)催化剂;使逆反应速率瞬时加快的因素有B.增大压强、C.升高温度、D.加(正)催化剂、E.增加NH3浓度。
2NH3(g) ΔH<0可知A.增大N2和H2的浓度是瞬间增大了正反应速率,逆反应速率不变;B.增大压强、C.升高温度、D.加(正)催化剂均可瞬间同时增大正、逆反应速率;E.增加NH3浓度是瞬间增大了逆反应速率,正反应速率不变;故使正反应速率瞬间增大的条件有:A.增大N2和H2的浓度、B.增大压强、C.升高温度、D.加(正)催化剂;使逆反应速率瞬时加快的因素有B.增大压强、C.升高温度、D.加(正)催化剂、E.增加NH3浓度。
考点:外界条件对反应速率的影响。
本题难度:一般
2、简答题 (18分)钛被誉为“二十一世纪的金属”,用途广泛。按下图所示组成的产业链可以大大提高资源利用率并能减少环境污染。请回答下列问题: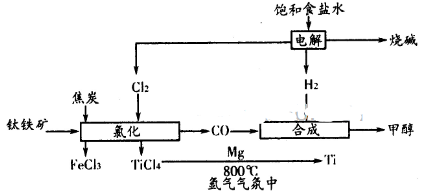
(1)已知中FeTiO3元素的化合价为+3,钛铁矿经氯化法得到四氯化钛的过程中________元素被氧化,每生产1. 9kgTiCl4消耗Cl2在标准状况下的体积为________L。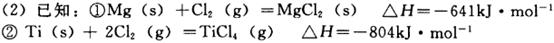
则金属Mg还原TiCl4制取金属Ti (s)的热化学方程式为___________.
(3)某化学兴趣小组探究外界条件对合成甲醇反应的影响。
①在300℃时,向体积为1L的密闭容器中加入2mol H2和1mol CO,CO和CH3OH(g)的浓度随时间变化如图所示。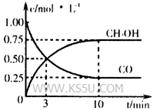
则从反应开始到建立平衡,v(H2)为___________ ;
该温度下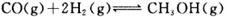 的化学平衡常
的化学平衡常
数为___________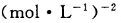 。
。
②在其它条件不变,只改变其中的一个条件,该小组同学
根据实验绘制如下图像,其中与事实相符的是为___________(填
序号)。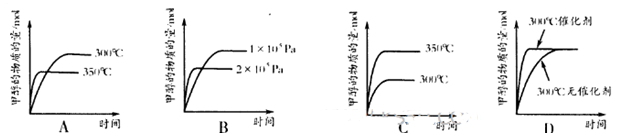
(4)电解饱和食盐水是氯碱工业的基础。
①电解饱和食盐水的离子方程式为为___________ 。
②电解时用盐酸控制阳极区溶液的pH在2~3,盐酸的作用为为___________。(用必要的离子方程式和文字说明)
参考答案:(18分)
(1)Ti、C(2分),784(3分)
(2)2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s)?H=-478kJ?mol?1(2分)
(3)①0.15mo?L-1?min-1(2分)? 12(2分)
②AD(3分)(缺1项扣1分,有错误选项不给分)
(4)①2Cl?+2H2O  H2↑+Cl2↑+2OH?(2分)
H2↑+Cl2↑+2OH?(2分)
②Cl2与H2O反应:Cl2+H2O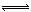 H++Cl?+HClO,增大H+浓度使平衡逆向移动,减少Cl2在水中的溶解,有利于Cl2逸出。(2分)
H++Cl?+HClO,增大H+浓度使平衡逆向移动,减少Cl2在水中的溶解,有利于Cl2逸出。(2分)
本题解析:(1)根据流程图可知FeTiO3、C、Cl2反应生成FeCl3、TiCl4、CO,化合价升高的元素为Ti和C,所以Ti和C元素被氧化;1. 9kgTiCl4消物质的量为:1900g÷190g/mol=10mol,根据FeTiO3可知生成的FeCl3和TiCl4物质的量相等,都是10mol,根据Cl元素守恒Cl2的物质的量为(30mol+40mol)÷2=35mol,所以消耗Cl2在标准状况下的体积为:35mol×22.4L/mol=784L。
(2)首先写出金属Mg还原TiCl4制取金属Ti (s)的化学方程式,并注明状态:2Mg(s)+TiCl4(g)=2MgCl2(s)+
Ti(s),然后根据盖斯定律求焓变,?H=2?H1—?H2=-478kJ?mol?1,可得热化学方程式。
(3)①v(H2)=v(CH3OH)=2×0.75mol/L÷10min=0.15mo?L-1?min-1;根据三段式进行计算:
CO(g) + 2H2(g) 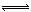 ?CH3OH(g)
?CH3OH(g)
起始浓度(mol?L?1)? 1? 2? 0?
转化浓度(mol?L?1)? 0.75? 1.5? 0.75
平衡浓度(mol?L?1)? 0.25? 0.5? 0.75
则化学平衡常数为:0.75mol/L÷[0.25mol/L×(0.5mol/L )2] =12(mol?L?1)-2
② A、CO与H2生成CH3OH的反应为放热反应,350℃大于300℃,反应速率加快,平衡向逆反应方向移动,甲醇的物质的量减小,正确;B、该反应正反应方向气体系数减小,所以增大压强平衡向右移动,甲醇的物质的量增大,图像错误;C、该反应为放热反应,350℃大于300℃,反应速率加快,平衡向逆反应方向移动,甲醇的物质的量减小,图像错误;D、催化剂能加快反应速率,但不影响化学平衡,图像正确。?
(4)①电解饱和食盐水生成H2、Cl2、NaOH,离子方程式为:2Cl?+2H2O  H2↑+Cl2↑+2OH?
H2↑+Cl2↑+2OH?
②因为阳极生成Cl2,Cl2能溶于H2O且与水反应:Cl2+H2O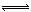 H++Cl?+HClO,加入盐酸控制阳极区溶液的pH在2~3,增大H+浓度使平衡逆向移动,减少Cl2在水中的溶解,有利于Cl2逸出。
H++Cl?+HClO,加入盐酸控制阳极区溶液的pH在2~3,增大H+浓度使平衡逆向移动,减少Cl2在水中的溶解,有利于Cl2逸出。
本题难度:一般
3、选择题 常温下,0.2 mol·L-1的盐酸30mL分别与下列Na2CO3溶液混合,再加水稀释到100mL,其中最初产生CO2的速率最快的是
A.20mL0.3 mol·L-1Na2CO3
B.10mL0.4 mol·L-1Na2CO3
C.25mL0.4 mol·L-1Na2CO3
D.15mL0.5 mol·L-1Na2CO3
参考答案:C
本题解析:0.2 mol·L-1的盐酸30mL分别与Na2CO3溶液混合,再加水稀释到100mL时,就只考虑每一种Na2CO3溶液所含有的Na2CO3的物质的量的多少,含有的Na2CO3的物质的量的越多,溶液的浓度越大,最初产生CO2的速率最快:A、20mL*0.3 mol·L-1="0.006" mol Na2CO3? B、10mL*0.4 mol·L-1="0.004" mol Na2CO3,C、25mL*0.4 mol·L-1="0.01" mol Na2CO3?D、15mL*0.5 mol·L-1="0.0075" mol Na2CO3,所以C项溶液中含有的Na2CO3的物质的量最多,最初产生CO2的速率最快,正确。
本题难度:简单
4、填空题 加0.1 mol MnO2粉末于50 mL过氧化氢(H2O2,ρ=1.1 g· mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。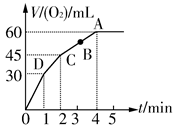
(1)实验时放出气体的总体积是_____________________________。
(2)放出一半气体所需时间为_______________________________。
(3)反应放出气体总体积的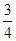 ?所需的时间约为__________________
?所需的时间约为__________________
(4)A、B、C、D各点反应速率快慢的顺序为____________________
(5)解释反应速率变化的原因___________________________________________________
(6)计算H2O2的初始物质的量浓度____________________
(7)求反应到2 min时,H2O2的质量分数_________________________
参考答案:(1)60 mL (2)1 min (3)2 min (4)D>C>B>A
(5)随着反应的进行,c(H2O2)逐渐降低,反应逐渐变慢
(6)0.107 mol·L-1 (7)0.084%
本题解析:根据V-t图像知,反应进行至1 min时,放出O2的体积为30 mL,反应进行至2 min时,放出O2 45 mL,反应进行至4 min,放出O2的体积达最大值60 mL;由V-t曲线的斜率变化可知:D、C、B、A的反应速率逐渐减小,这是因为随着反应的进行,c(H2O2)逐渐降低,反应逐渐变慢;根据2H2O2 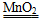 2H2O+O2↑,n(H2O2)=?
2H2O+O2↑,n(H2O2)=?
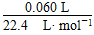 ×2,所以H2O2的起始物质的量浓度为:?
×2,所以H2O2的起始物质的量浓度为:?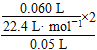 =0.107 mol·L-1;反应进行至2 min时,消耗H2O2的物质的量为
=0.107 mol·L-1;反应进行至2 min时,消耗H2O2的物质的量为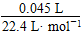 ×2=0.004 mol,剩余H2O2的物质的量为
×2=0.004 mol,剩余H2O2的物质的量为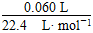 ×2-0.004 mol=1.36×10-3 mol。
×2-0.004 mol=1.36×10-3 mol。
所以w(H2O2)=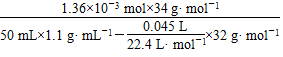 ×100%≈0.084%。
×100%≈0.084%。
本题难度:一般
5、选择题 反应C(s)+H2O(g)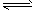 CO(g)+H2(g)在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
[? ]
A.增加碳的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大
参考答案:AC
本题解析:
本题难度:一般