时间:2021-06-11 05:47:56
1、填空题 在800℃时,在2L密闭容器中将一定量的NO和O2混合发生反应 ,n(NO)随时间的变化如下表:
,n(NO)随时间的变化如下表:
| 时间/s | 0 | 10 | 20 | 30 | 40 | 50 |
| n(NO)/mol | 0.2 | 0.1 | 0.08 | 0.07 | 0.07 | 0.07 |
参考答案:(1)0.0015mol/(L.S) (2分),65%(2分)
(2)放(2分)
(3)ADE(2分)
(4)CD(2分)
(5)2NO (g)+ O2(g) 2NO2(g);△H = —12.5aKJ·mol-1(3分);
2NO2(g);△H = —12.5aKJ·mol-1(3分);
本题解析:
(1)根据方程式2NO+O22NO2,可知参加反应的氧气的物质的量为
1/2×(0.2-0.08)mol=0.06mol;
所以20s内,以O2表示的反应速率为v=△c/△t=0.06mol/2L/20s==0.0015mol·L-1.s;
由表中数据可知,开始NO的物质的量为0.2mol,30s时反应达平衡,平衡时NO的物质的量为0.07mol.
参加反应NO的物质的量为0.2mol-0.07mol=0.13mol,
达到平衡时NO的转化率为0.13mol/0.2mol×100%=65%.
故答案为:0.0015mol/(L.S);65%.
(2)升温到850℃,平衡后n(NO)=n(NO2),根据N原子守恒可知n(NO)=n(NO2)=0.1mol,平衡向逆反应进行,升高温度平衡向吸热反应进行,所以正反应为放热反应.
故答案为:放.
(3)A、恒温恒容,反应前后气体体积减小,所以随反应进行压强减小,当压强不变,说明到达平衡,故A正确;
B、反应混合物都为气体,总质量不变,体积不变,密度自始至终不变,故B错误;
C、一定条件下达平衡时n(NO)=n(NO2)可能相等,条件不同n(NO)=n(NO2)反应不一定处于平衡状态,故C错误;
D、有颜色气体为二氧化氮,颜色不变,说明二氧化氮的浓度不再发生变化,说明反应到达平衡,故D正确;
E、混合气体总的质量不变,总的物质的量随反应进行减小,平均相对分子质量减小,当平均相对分子质量不变时,说明反应到达平衡,故E正确;
F、自反应开始v(NO2)为v(O2)的2倍,所以v(NO2)=2v(O2),不能说明达平衡,故F错误.故选:ADE
(4)A.移去部分NO,平衡向逆反应进行,故A错误;
B.加入了一定量的NO气体,平衡向正反应进行,移动的目的是减小NO增大趋势,但平衡时物质的量比原来多,故B错误;C.改变某一条件,达新平衡时n(NO)=0.06mol,比原平衡小,若平衡向正反应移动,此时改变条件不可能是增大NO的物质的量,若一定量的NO气体,平衡向正反应进行,移动的目的是减小NO增大趋势,但平衡时物质的量比原来多,NO的转化率一定增大.
若移去部分NO,平衡向逆反应进行,可等效为开始加入的NO少些,氧气不变,与原平衡相比,NO转化率增大.故C正确.
D.小了容器的体积,压强增大,平衡向体积减小的方向移动,即向正反应移动,NO的物质的量减少,故D正确.
故选:CD
(5)转化的NO的物质的量为2mol×80%=0.16mol,放出的热量为akJ,所以2molNO反应放出的热量为2mol/0.16mol×akJ=12.5aKJ,所以热化学反应方程式为2NO (g)+O2(g)2NO2(g);△H=-12.5aKJ?mol-1.
故答案为:2NO (g)+O2(g)2NO2(g);△H=-12.5aKJ?mol-1.
本题难度:一般
2、填空题 (2分)反应 在四种不同情况下的反应速率分别为
在四种不同情况下的反应速率分别为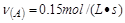 ? ②
? ②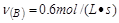 ? ③
? ③ ?④
?④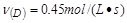
该反应进行的快慢顺序为?。
参考答案:④>②=③>①
本题解析:
全转换成以A表示的速率分别是①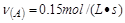 ?②
?②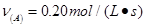 ③
③ ④
④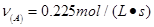
该反应进行的快慢顺序为④>②=③>①
方程式的系数比转换为以同种物质表示的反应速率即可进行比较
本题难度:一般
3、选择题 决定化学反应速率的主要因素是
A.反应物的浓度
B.反应温度
C.使用催化剂
D.反应物的性质
参考答案:D
本题解析:决定化学反应速率的主要因素是反应物自身的性质,D正确;浓度、温度以及催化剂都是外界条件,不是决定反应速率的主要因素,答案选D。
本题难度:简单
4、选择题 在673K、30MPa下,在密闭容器中进行合成氨反应: N2(g)+3H2(g) 2NH3(g)?△H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是
2NH3(g)?△H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是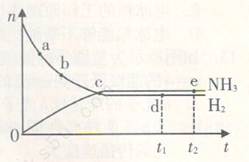
A.正反应速率:a点小于b点
B.c点处反应达到平衡
C.d点和e点处的n(N2)不一样
D.若其他条件不变,在773 K时反应至t1时刻,n(H2)比图中d点对应的n(H2)大
参考答案:D
本题解析:在N2(g)+3H2(g) 2NH3(g)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,反应物的生成物的物质的量不再改变,曲线为水平直线,以此判断题中各项。A、随着反应的进行,反应物的浓度之间减小,反应速率逐渐减小,则a点的正反应速率比b点大,故A错误;B、c点反应物和生成物物质的量仍在变化,没有达到平衡状态,故B错误;C、d点和e点都处于平衡状态,n(N2)不变,d点和e点n(N2)相等,故C错误;D、该反应是放热反应,升高温度,平衡向逆反应方向移动,所以平衡时氢气的物质的量比d点的值大,故D正确;故选D。
2NH3(g)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,反应物的生成物的物质的量不再改变,曲线为水平直线,以此判断题中各项。A、随着反应的进行,反应物的浓度之间减小,反应速率逐渐减小,则a点的正反应速率比b点大,故A错误;B、c点反应物和生成物物质的量仍在变化,没有达到平衡状态,故B错误;C、d点和e点都处于平衡状态,n(N2)不变,d点和e点n(N2)相等,故C错误;D、该反应是放热反应,升高温度,平衡向逆反应方向移动,所以平衡时氢气的物质的量比d点的值大,故D正确;故选D。
本题难度:一般
5、填空题 如下图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL盐酸,试回答下列问题。
⑴实验中观察到的现象是________ ____________ _______________
_____________________ ______ _________。
⑵产生上述现象的原因是____ _______ ______________
_____________________ _____ _________。
⑶写出有关反应的离子方程式_ _______________________。
⑷由实验推知,MgCl2溶液和H2的总能量____________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
参考答案:(1)①镁片上有大量气泡产生;②镁片逐渐溶解;③烧杯中溶液变浑浊
(2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中溶解度水温度升高而减小,故析出Ca(OH)2固体
(3)Mg+2H+=Mg2++H2 ↑ (4)小于
本题解析:镁是活泼的金属,能和盐酸反应生成氢气和氯化镁。该反应是放热反应,说明反应物的总能量高于生成物的总能量。溶液温度升高,但由于Ca(OH)2在水中溶解度水温度升高而减小,所以析出Ca(OH)2固体。
本题难度:一般