时间:2021-06-11 05:45:46
1、选择题 CO2通入下列溶液中,不可能产生沉淀的是
A.饱和Na2CO3溶液
B.石灰水
C.Ba(OH)2溶液
D.CaCl2
参考答案:D
本题解析:考查二氧化碳的性质,涉及反应为:
Na2CO3+CO2+H2O=2NaHCO3↓(由于NaHCO3的溶解度相对小,故CO2通入饱和Na2CO3溶液时,将析出NaHCO3结晶)
Ca(OH)2+CO2=CaCO3↓+H2O
Ba(OH)2+CO2=BaCO3↓+H2O
由于弱酸不能制强酸,与CaCl2不能反应,故答案为D
本题难度:简单
2、选择题 2009年2月有人在德市白沙镇采矿点浮选所使用的盐酸、硫酸流进农田山沟后,污染环境水质,造成水土流失,是几代人都无法挽回的。A、B、C、D四地的地理位置如下图所示,交通均较为便利,其它的地理条件如下: ?
?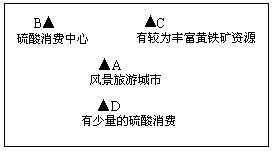
 根据以上信息,硫酸厂厂址应选择在(?)
根据以上信息,硫酸厂厂址应选择在(?) A.A地? B.B地? C.C地?D.D地
A.A地? B.B地? C.C地?D.D地
参考答案:B
本题解析:考虑到硫酸运输的费用是黄铁矿运费的多倍,硫酸厂厂址应该选择在硫酸的消费中心B地。
本题难度:一般
3、选择题 广东正在建设海洋强省。下列说法不正确的是( )。
A.从海带中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、Mg、B等金属
参考答案:D
本题解析:B是硼元素,硼元素是非金属元素不是金属元素。
本题难度:一般
4、选择题 汉代器物上的颜料“汉紫”至今尚没有发现其自然存在的记载.20世纪80年代科学家进行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式为BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法中不正确是(? )
A.用盐的形式表示:BaSiO3?CuSiO3
B.用氧化物形式表示:BaO?CuO?2SiO2
C.易溶于强酸、强碱
D.性质稳定,不易褪色
参考答案:C
本题解析:
本题难度:简单
5、实验题 从海水提取镁和溴的流程如下,请回答相关问题。
(1)从海水中提取镁的流程如下图所示(框图中是主要产物):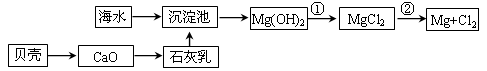
i.海水进入沉淀池前,对海水进行处理有以下两种方案:
方案一:将晒盐后的卤水通入沉淀池;
方案二:将加热蒸发浓缩后的海水通入沉淀池。
你认为方案________更合理,理由是_________________________________________。
ii.反应①的离子方程是________________________________________________。
反应②的化学方程式是_______________________________________________。
(2)从海水中提取溴的流程如下图所示(框图中是主要产物):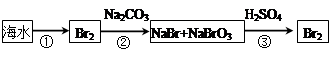

i.过程①中,加入的试剂是___________。
ii.过程②中,向混合液中吹入热空气,将溴吹出,用纯碱吸收,吹入热空气的目的是______________________________________________________________________。
iii.过程③中反应的化学方程式是____________________________________________。
iv.若最终得到的溴单质中仍然混有少量的Cl2,则除去该杂质的方法是__________________________________________________(结合离子方程式回答)。
参考答案:(9分)(1)i. 一?要加热海水需大量的能源,浪费了能源
ii. Mg(OH)2+2H+=Mg2++2H2O ; MgCl2(熔融)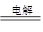 Mg+Cl2↑
Mg+Cl2↑
(2)i.? Cl2
ii.温度升高,气体的溶解度减小,另外空气不与溴发生反应,可以搅动液体,有利于溴蒸汽的逸出
iii.5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O(2分)
iv.加入适量溴化钠,利用有机溶剂将溴分离提纯,Cl2+2Br-=Br2+2Cl-
本题解析:(1)i.由于蒸发浓缩海水需要加热海水,从而消耗大量的能源,浪费了能源,所以方案一最好。
ii.氢氧化镁转化为氯化镁,需要将氢氧化镁溶解在盐酸中,反应的离子方程式是Mg(OH)2+2H+=Mg2++2H2O;镁是活泼的金属,需要电解法冶炼,电解熔融的氯化镁即可生成金属镁和氯气,反应的化学方程式是MgCl2(熔融) Mg+Cl2↑。
Mg+Cl2↑。
(2)i.海水中的溴是以溴离子的形成存在的,需要加入氧化剂将其氧化生成单质溴,因此过程①中,加入的试剂是Cl2。
ii.由于温度升高,气体的溶解度减小,另外空气不与溴发生反应,可以搅动液体,有利于溴蒸汽的逸出,因此要吹入热空气。
iii.在酸性条件下,溴酸钠能和溴化钠发生氧化还原反应生成单质溴,反应的化学方程式是5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O。
iv. 氯气具有强氧化性,所以要出去单质溴中的少量氯气,可以加入适量溴化钠,利用有机溶剂将溴分离提纯,反应的离子方程式是Cl2+2Br-=Br2+2Cl-。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以海水的综合应用为载体,有利于调动学生的学习兴趣,激发学生的学习求知欲。
本题难度:一般