时间:2021-06-11 05:43:35
1、选择题 在298K、100kPa时,已知:2H2O(g) = 2H2(g) + O2(g) ΔH1; Cl2(g) + H2(g) = 2HCl(g) ΔH2
2Cl2(g) + 2H2O(g) = 4HCl(g) + O2(g) ΔH3; 则ΔH3与ΔH1和ΔH2间的关系正确的是
[? ]
A.ΔH3=ΔH1+2ΔH2
B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2
D.ΔH3=ΔH1-ΔH2
参考答案:A
本题解析:
本题难度:一般
2、填空题 (1)P4(s,白磷)+5O2(g)=P4O10(s)△H1=-2983.2kJ/mol(2)P(s,红磷)+
| 5 4 |
| 1 4 |
参考答案:P4(s,白磷)+5O2(g)=P4O10(s)△H1=-2983.2kJ/mol…①
P(s,红磷)+54O2(g)=14P4O10(s)△H2=-738.5kJ/mol,…②
根据盖斯定律:①-②×4可得:P4(s,白磷)=4P(s,红磷)△H=(-2983.2kJ/mol)-(-738.5kJ)×4=-29.2kJ/mol,说明白磷转化为红磷是放热反应,相同的状况下,红磷能量比白磷低,红磷比白磷稳定,故答案为:P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol;红磷;低.
本题解析:
本题难度:一般
3、选择题 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1
N2(g)+O2(g)═2NO(g)△H=+180kJ?mol-1
则2CO(g)+2NO(g)═N2(g)+2CO2(g)的△H是( ?)
A.-386?kJ?mol-1
B.+386?kJ?mol-1
C.-746?kJ?mol-1
D.+746?kJ?mol-1
参考答案:C
本题解析:
本题难度:一般
4、选择题 2012年6月16日我国成功发射了“神州九号”.这标志着中国人的太空时代又前进了一大步.发射“神九”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知:
N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是( )
A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7?kJ/mol
B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1000.3?kJ/mol
C.N2H4(g)+NO2(g)=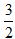 N2(g)+2H2O(l);△H=-1135.7?kJ/mol
N2(g)+2H2O(l);△H=-1135.7?kJ/mol
D.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7?kJ/mol
参考答案:D
本题解析:
本题难度:简单
5、选择题 已知常温时红磷比白磷稳定,在下列反应中:
4P(白磷,s)+5O2(g)====2P2O5(s);△H=-a kJ/mol
4P(红磷,s)+5O2(g)====2P2O5(s);△H=-b kJ/mol
若a、b均大于零,则a和b的关系为
[? ]
参考答案:C
本题解析:
本题难度:一般