时间:2021-06-11 05:43:35
1、填空题 利用盖斯定律解答下列各小题
(1)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:______.
(2)25℃、101kPa下:①2Na(s)+
| 1 2 |
参考答案:(1)已知①TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1;
②2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1,
TiO2和焦炭、氯气反应生成TiCl4和CO气体的化学方程式为:2C+TiO2+2Cl2═TiCl4+2CO,可以根据①+②得到,所以反应的焓变═+140kJ?mol-1+(=-221kJ?mol-1)=-81kJ?mol-1,
故答案为:2C(s)+TiO2(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ?mol-1;
(2)已知::①2Na(s)+12O2(g)═Na2O(s)△H1=-414kJ?mol-1
②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ?mol-1
Na2O2和Na生成Na2O的化学方程式为:2Na+Na2O2=2Na2O,可以根据①×2-②得到,所以反应的焓变=(-414kJ?mol-1)×2-(-511kJ?mol-1)=-317kJ?mol-1,
故答案为:2Na(s)+Na2O2(s)=2Na2O(s)△H1=-317kJ?mol-1;
(3)已知:①C?(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1;
②2H2(g)+O2(g)=2H2O?(l)△H2=-571.6kJ?mol-1;
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O?(l)△H2=-2599kJ?mol-1;
2C?(s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×12-③×12得到,
所以反应焓变△H=2×(-393.5kJ?mol-1)+(-571.6kJ?mol-1)×12-(-2599kJ?mol-1)×12=226.7kJ?mol-1,
故答案为:2C?(s,石墨)+H2(g)=C2H2(g),△H1=226.7kJ?mol-1.
本题解析:
本题难度:一般
2、选择题 已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) === 2CO2(g)+2H2O(l) △H1= -870.3 kJ·mol-1
(2)C(s)+O2(g) === CO2(g) △H2= -393.5 kJ·mol-1
(3)H2(g)+1/2O2(g) === H2O(l) △H3= -285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l) 的焓变△H为
[? ]
A.488.3kJ·mol-1?
B.-244.15kJ·mol-1?
C.244.15kJ·mol-1?
D.-488.3kJ·mol-1?
参考答案:D
本题解析:
本题难度:一般
3、选择题 已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和
-1366.8kJ mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
[? ]
参考答案:D
本题解析:
本题难度:一般
4、选择题 已知:Fe2O3(s)+3/2C(s)= 3/2CO2(g)+2Fe(s) △H =+234.1kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1 则2Fe(s)+3/2O2(g)=Fe2O3(s)的△H是
[? ]
A.-824.4kJ·mol-1
B.-627.6kJ·mol-1
C.-744.7kJ·mol-1
D.-169.4kJ·mol-1
参考答案:A
本题解析:
本题难度:一般
5、简答题 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.
(1)合成甲醇的反应为:CO(g)+2H2(g)CH3OH(g);图1表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H______0.(填“>、<或=”下同)
(2)若在230℃时,平衡常数K=1.若其它条件不变,将温度升高到500℃时,达到平衡时,K______1.
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol?CO和7.5mol?H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的______倍.
(4)利用甲醇燃料电池设计如图2所示的装置:
①则该装置中b为______极,写出装置中电解池内发生反应的离子方程式______,
②当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为______L.
(5)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(l)═C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式______.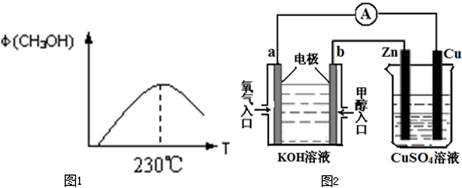
参考答案:(1)根据图示信息,当达到化学平衡以后(甲醇含量的最高点),升高温度,甲醇的体积分数减小,说明平衡逆向移动,所以该反应是一个放热反应,故答案为:<;
(2)对于放热反应,升高温度,K减小,故答案为:<;
(3)根据题意得到:CO(g)+2H2(g)?CH3OH(g)
初始物质的量(mol)? 2.5? 7.5? 0?
变化的物质的量(mol)?2.25? ?4.5? 2.25
平衡的物质的量?(mol)0.25? 3?2.25
所以此时容器内的压强和开始时的比值为:0.25+3+2.252.5+7.5=0.55,故答案为:0.55;
(4)①由图可知,甲醇燃料电池中通入氧气的为正极,b为电池的负极,后边的烧杯为电解池装置,锌与b相连,则锌极为阴极,Cu为阳极,装置相当于在金属锌上镀铜,锌极:Cu2++2e-=Cu,Cu极:Cu=2e-+Cu2+,
故答案为:锌极:Cu2++2e-=Cu,Cu极:Cu=2e-+Cu2+;
?②根据Cu电极反应:Cu=2e-+Cu2+,当铜片的质量变化为12.8g时,转移电子是0.4mol,
a极上电极反应:O2+4e-+2H2O-═4OH-,转移电子是0.4mol时,消耗的O2在标准状况下的体积为2.24L,
故答案为:2.24;
(5)①2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H1=+1411.0kJ/mol
②2CO2(g)+3H2O(l)═C2H5OH(1)+3O2(g)△H2=+1366.8kJ/mol
根据盖斯定律反应C2H4(g)+H2O(l)═C2H5OH(l)等于②-①,所以△H=△H2-△H1=-44.2?kJ/mol,
故答案为:C2H4(g)+H2O(l)═C2H5OH,△H=-44.2?kJ/mol.
本题解析:
本题难度:一般