时间:2021-06-11 05:42:09
1、填空题 (15分)某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度。实验步骤:①配制500mL浓度约为0.1 mol·L-1的NaOH溶液;②用物质X的标准溶液准确测定该NaOH溶液的浓度(X与氢氧化钠按物质的量比1:1完全反应);③用已知准确浓度的NaOH溶液测定醋酸的浓度。
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解。该配制步骤__________(填“可行”或“不可行”)。
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期_____(填“小”或“大”),这是不能直接配制其标准溶液的原因。
(3)查阅白醋包装说明,醋酸含量约为6g/100mL,换算成物质的量浓度约为_____ mol·L-1,滴定前将白醋稀释_________(填“10”或“100”)倍。(已知醋酸的相对分子质量为60)
(4)稀释白醋时需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、___________。
(5)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加水30mL,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至____________即为终点。重复滴定两次,平均消耗NaOH标准溶液V mL(NaOH溶液浓度为c mol·L-1)。
(6)原白醋中醋酸的物质的量浓度=____________ mol·L-1。
2、实验题 (1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者?后者(填“<”、“>”或“=”).
(2)在25℃条件下将pH=5的氯化铵溶液稀释100倍 ,稀释后溶液的pH为(填选项字母,下同)?.
,稀释后溶液的pH为(填选项字母,下同)?.
A.5? B.7 ?C.3~5之间? D.5~7之间
(3)将体积和物质的量浓度都相同的醋酸和氢氧化钠溶液混合后,溶液呈?性(填“酸”,“中”或“碱”,下同),溶液中c(Na+)?c(CH3COO-)(填“ >” 或“=”或“<”,下同 )。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈?性,溶液中c(Na+)?c(CH3COO-)
(5)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)?氢氧化钠溶液中c(OH-),m与n的大小关系是m?n。
(6)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是?。(多选、错选不得分)
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
E.未用标准液润洗碱式滴定管。
3、选择题 已知甲烷燃烧生成二氧化碳和液态水放出的热量为55.625kJ·g-1。下列热化学方程式中不正确的是( )
A.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H =-890kJ/mol
B.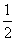 CH4(g)+O2(g)=
CH4(g)+O2(g)=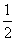 CO2(g)+H2O(l);△H=-445kJ/mol
CO2(g)+H2O(l);△H=-445kJ/mol
C.
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-55.625kJ/mol
4、选择题 已知常温下CH3COOH的电离平衡常数为Ka。常温下,向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是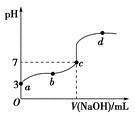
A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中 相等
相等
5、选择题 取浓度相同的Na0H和HCl溶液,以3∶2 体积比相混合,所得溶液的pH 等于12,则原溶液的浓度为?(?)
A.0.01mol/L
B.0.017mol/L
C.0.05mol/L
D.0.50mol/L