时间:2021-06-11 05:41:24
1、简答题 在一个固定的反应器中,有一可以自由滑动的密封隔板,两侧分别进行如图所示的化学反应(均加有适量的新型固体催化剂,体积忽略).
| 2SO2(g)+O2(g)?2SO3(g) | N2(g)+3H2(g)?2NH3(g) |
2、填空题 (11分)(1)一定温度下,在恒容密闭容器中N2O5可发生下 列反应:2N2O5(g)
列反应:2N2O5(g)  4NO2(g)+O2(g) ;⊿H>0
4NO2(g)+O2(g) ;⊿H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将?(填“增大”、
“减小”或“不变”)。
②下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 10 00 00 |
| c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |

3、选择题 在水溶液中,重铬酸钾K2Cr2O7存在以下平衡:

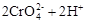 ,下列说法正确的是
,下列说法正确的是
A.向该溶液中加入过量浓NaOH溶液后,溶液呈橙红色
B.该反应不是氧化还原反应
C.向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大
D.该反应的平衡常数表达式是
4、选择题 在一定温度下将1 mol CO和1 mol水蒸气放入一固定容积的密闭容器中,反应CO(g)+H2O(g)? ?CO2(g)+H2(g)达平衡后,得到0.6 mol CO2;再通入0.3 mol水蒸气,达到新平衡状态后,CO2的物质的量可能是( )
?CO2(g)+H2(g)达平衡后,得到0.6 mol CO2;再通入0.3 mol水蒸气,达到新平衡状态后,CO2的物质的量可能是( )
A.0.9 mol
B.0.8 mol
C.0.7 mol
D.0.6 mol
5、填空题 (14分)如图的甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1 mol A、3 mol B,此时两容器体积均为500 mL,温度为T℃。保持温度不变,发生反应A(g)+3B(g) 2C(g)+D(s);△H<0。
2C(g)+D(s);△H<0。
 (1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是________。
(1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是________。
A.混合气体的总质量不随时间改变? B.2 v正(C)=3 v逆(B)
C.A、B转化率相等? D. 物质D的质量不随时间改变
(2)2 min后甲容器中的化学反应达到平衡, 测得C
测得C 的浓度为2 mol/L,此时容器的体积为________mL,B的转化率α甲(B)为________。
的浓度为2 mol/L,此时容器的体积为________mL,B的转化率α甲(B)为________。
(3)乙容器中反应 达到平衡所需要的时间______2 min(填“>、<或=”),B的转化率α
达到平衡所需要的时间______2 min(填“>、<或=”),B的转化率α 乙(B) ______α甲(B) (填“>、<或=”)。
乙(B) ______α甲(B) (填“>、<或=”)。
(4)若其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需要加入C的物质的量n(C)=________mol,加入D的物质的量n (D)应该满足的条件为________________________。