时间:2021-06-11 05:40:41
1、填空题 2013年初,雾霾天气多次肆虐我国中东部,该地区PM2.5严重超标。研究表明,PM2.5约60%来源于某些气体污染物在空气中转变而成的二次颗粒物。这些气体污染物主要有二氧化硫、氮氧化物、氨气、挥发性有机物。因此,控制、治理PM2.5污染源成为环保的重要课题。
(1)研究表明,TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,如图所示,OH与NO2的反应为NO2+OH HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是?。
HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是?。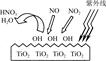
(2)如图所示的电解装置能吸收和转化NO2、NO和SO2。阴极排出的溶液中含S2O42-离子,能吸收NOx气体,生成的SO32-可在阴极区再生。请将S2O42-吸收NO2的离子方程式配平,并标明电子转移的方向和数目。
____S2O42-+____NO2+____OH- ?SO32-+____N2+____
?SO32-+____N2+____
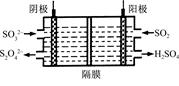
(3)已知上述电解装置阳极反应为:SO2-2e-+2H2O SO42-+4H+,阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为?。
SO42-+4H+,阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为?。
(4)PM2.5产生的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,大多含有重金属等有毒物质。一般而言,粒径2.5微米至10微米的粗颗粒物主要来自扬尘等;2.5微米以下的细颗粒物(PM2.5)则主要来自化石燃料的燃烧(如机动车尾气、燃煤)、挥发性有机物的排放等。请你结合信息,给出降低PM2.5排放的对策(至少两条):? ______?。
2、填空题 (14分)用浓盐酸来制取氯气的化学方程式如下:2KMnO4 +16HCl ="2KCl" +2MnCl2 + 5Cl2↑+8H2O,其中被还原的元素是?,被氧化的元素是?,氧化剂是 ?,还原剂是?,氧化产物是?,还原产物是?,假如有2.5 molCl2生成,则该反应中电子转移数目为___________________。
?,还原剂是?,氧化产物是?,还原产物是?,假如有2.5 molCl2生成,则该反应中电子转移数目为___________________。
3、选择题 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:
①湿法制备的主要反应方程式为:Fe(OH)3+ ClO—+ OH— → FeO42—+ Cl—+ H2O
②干法制备的主要反应方程式为: FeSO4+ Na2O2 → Na2FeO4+ Na2O+ Na2SO4 + O2↑
(均未配平)
下列有关说法不正确的是
A.高铁酸钠中铁显+6价
B.湿法制备的反应方程式中,氧化剂和还原剂的物质的量之比为3∶2
C.干法中每生成1 mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质
4、选择题 铬铁矿是铬和铁的氧化物形成的矿物,其化学成分可以表示为FeCr2O4。冶炼铬铁矿时发生的反应为
4FeCr2O4+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2↑。下列判断正确的是
8Na2CrO4+2Fe2O3+8CO2↑。下列判断正确的是
[? ]
A.铬铁矿中铁的化合价为+3
B.氧化产物只有Fe2O3
C.反应前后Cr的化合价没有变化
D.生成1 mol Na2CrO4时,转移的电子为3.5 mol
5、选择题 某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是
[? ]