时间:2021-06-11 05:37:47
1、选择题 三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧热△H=-3677kJ/mol(磷元素被氧化为P4O10),下列有关P4S3的说法中不正确的是( )
A.分子中每个原子最外层均达到8电子稳定结构
B.P4S3中磷元素为+3价
C.热化学方程式为P4S3(s)+8O2(g)=P4O10(s)+3SO2(g);△H=-3677kJ/mol
D.分子中存在极性键与非极性键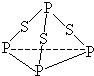
2、选择题 下列叙述正确的是()
A.P4和NO2都是共价化合物
B.次氯酸的结构式为H-Cl-O
C.在CaO和SiO2晶体中,都不存在单个小分子
D.CCl4和NH4Cl都是以共价键结合的分子
3、选择题 下列物质中既含有离子键又含有共价键的是
[? ]
A.Na2O
B.NaCl
C.H2O
D.NH4Cl
4、选择题 以下各分子中,所有原子都满足最外层为8电子结构的是
[? ]
A.H3O+
B.BF3
C.CCl4
D.pCl5
5、选择题 下列性质中,可以证明某化合物内一定存在离子键的是
[? ]
A.可溶于水
B.具有较高的熔点
C.水溶液能导电
D.熔融状态能导电