时间:2021-06-11 05:36:18
1、选择题 下列反应属于离子反应的是 ( )
A.H2和O2反应生成水
B.铁片投入稀硫酸中
C.NH4HCO3受热分解
D.NH3遇HCl气体生成白烟(NH4Cl)
参考答案:B
本题解析:略
本题难度:一般
2、选择题 下列图示与对应的叙述相符的是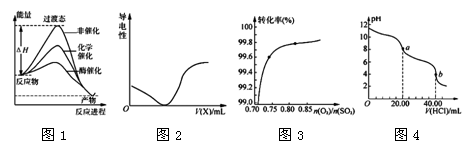
A.由图1所示曲线可知,化学催化比酶催化的效果好
B.在H2S溶液导电性实验中,由图2所示曲线可确定通入的气体X为Cl2
C.在其它条件不变时,2SO2(g)+ O2(g) 2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率
2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率
D.图4是用0.l000 mol·L-1的盐酸滴定20.00 mL 0.l000mol·L-1 Na2CO3溶液的曲线,从a→b点反应的离子方程式为:HCO3-+H+= CO2↑+H2O
参考答案:D
本题解析:A.由图1所示曲线可知,酶使反应的活化能大大降低,化学反应速率大大加快,因此化学催化不如酶催化的效果好,错误;B.在H2S溶液导电性实验中,开始加入Cl2,会发生反应:H2S+ Cl2=2HCl+S↓,由于H2S是弱酸,HCl是强酸,加入后溶液的导电性应该加强,不是减弱,因此由图2所示曲线可确定通入的气体X不是Cl2,错误;C.在其它条件不变时,2SO2(g)+ O2(g) 2SO3(g)转化关系(图3)中,可知混合气体中氧气的含量越大,则SO2的转化率就越大,所以纵坐标表示SO2的转化率,错误;D.Na2CO3是强碱弱酸盐,水解是溶液显酸性,随着盐酸的滴加,不断发生反应Na2CO3,溶液的碱性减弱,pH不断减小,当滴加20.00ml盐酸时物质变为NaHCO3和NaCl,此后再滴加盐酸,从a→b点反应的离子方程式为:HCO3-+H+= CO2↑+H2O,正确。
2SO3(g)转化关系(图3)中,可知混合气体中氧气的含量越大,则SO2的转化率就越大,所以纵坐标表示SO2的转化率,错误;D.Na2CO3是强碱弱酸盐,水解是溶液显酸性,随着盐酸的滴加,不断发生反应Na2CO3,溶液的碱性减弱,pH不断减小,当滴加20.00ml盐酸时物质变为NaHCO3和NaCl,此后再滴加盐酸,从a→b点反应的离子方程式为:HCO3-+H+= CO2↑+H2O,正确。
考点:考查图像法再表示化学反应过程及反应原理的应用的知识。
本题难度:一般
3、选择题 下列离子方程式中正确的是
A.向硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS- CuS↓+H2S↑
CuS↓+H2S↑
B.Fe3O4溶解在过量的稀硝酸中:Fe3O4+8H+ Fe2++2Fe3++4H2O
Fe2++2Fe3++4H2O
C.碳酸氢铵溶液与苛性钾溶液混和共热:NH4++OH- NH3↑+H2O
NH3↑+H2O
D.将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O SO32-+2HClO
SO32-+2HClO
参考答案:A
本题解析:A、硫酸铜溶液中加入过量NaHS溶液,则铜离子与HS-发生双水解反应,生成CuS和硫化氢气体,正确;B、四氧化三铁与硝酸反应,则亚铁离子被氧化为铁离子,错误;C、碳酸氢铵与氢氧化钾共热,碳酸氢根离子也与氢氧根离子反应生成碳酸根离子和水,错误;D、二氧化硫与次氯酸钠反应,次氯酸钠具有强氧化性,所以应发生氧化还原反应,生成硫酸根离子和氯离子,错误,答案选A。
考点:考查离子方程式书写正误的判断
本题难度:一般
4、选择题 向四支盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入盐酸至过量,并将溶液加热,产生的气体与加入盐酸的物质的量的关系如下图所示: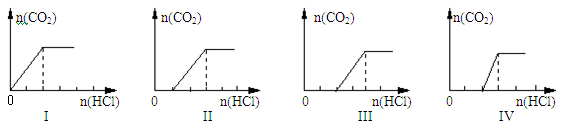
则下列分析都正确的组合是
| 选项 | 溶质的成分 | 对应图象 | 溶液中离子浓度关系 |
| A | NaHCO3 | I | c(Na+) = c(HCO3-) |
| B | NaOH、Na2CO3 | Ⅳ | c(OH-)>c(CO32-) |
| C | Na2CO3 | Ⅲ | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D | NaHCO3、Na2CO3 | Ⅱ | c(CO32-)>c(HCO3-) |
参考答案:B
本题解析:A、根据图1可判断加入盐酸立即产生气体,说明溶液中溶质是碳酸氢钠,由于碳酸氢根存在水解和电离,则溶液中c(Na+) > c(HCO3-),A错误;B、如果溶质是氢氧化钠和碳酸钠,则加入盐酸后首先中和氢氧化钠,然后与碳酸钠反应生成碳酸氢钠,最后与碳酸氢钠反应生成CO2和水,图像Ⅳ符合。根据图像可知氢氧化钠与碳酸钠的物质的量相等,当由于碳酸根水解,则溶液中c(OH-)>c(CO32-),B正确;C、如果溶质只有碳酸钠,则加入盐酸后碳酸钠与盐酸反应生成碳酸氢钠,然后碳酸氢钠与盐酸反应放出CO2,由于两次消耗的盐酸相等,则图像Ⅲ不符合,且根据物料守恒可知c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),C错误;D、如果溶质是碳酸钠和碳酸氢钠的混合物,则加入盐酸后碳酸钠与盐酸反应生成碳酸氢钠,然后碳酸氢钠与盐酸反应放出CO2,图像Ⅱ符合。根据图像可知碳酸钠与碳酸氢钠的物质的量是相等的,当由于碳酸根的水解程度大于碳酸氢根的水解程度,因此溶液中c(CO32-)<c(HCO3-),D错误,答案选B。
考点:考查碳酸盐与盐酸反应的图像分析以及溶液中离子浓度大小比较
本题难度:一般
5、选择题 下列表示对应化学反应的离子方程式错误的是
A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+6H+=3I2+3H2O
B.向甲酸溶液中加入KOH溶液:HCOOH+OH-=HCOO-+H2O
C.将过量CO2通入冷氨水中:CO2+NH3?H2O=HCO3-+NH4+
D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O
参考答案:D
本题解析:试题分析:5I-+IO3-+6H+=3I2+3H2O中碘元素的化合价升降总数都是5,等号左右电荷总数都是0,各原子个数都相等,故A正确;甲酸是弱电解质或弱酸,甲酸钾是强电解质或可溶性盐,酸碱中和反应前后电荷守恒、原子守恒,故B正确;一水合氨是弱电解质或弱碱,二氧化碳是酸性氧化物或气体,因为二氧化碳过量,二者反应生成碳酸氢铵,碳酸氢铵是强电解质或可溶性盐,反应前后电荷守恒、原子守恒,故C正确;Ag+2H++NO3-=Ag++NO↑+H2O中氮元素化合价降低总数为3,银元素化合价升高总数为,得失电子数不相等,违反电子守恒原理,说明没有配平,正确的反应式为3Ag+4H++NO3-=3Ag++NO↑+2H2O,故D错误。
考点:考查离子方程式,涉及氧化还原反应、复分解反应、电子守恒、电荷守恒、原子守恒、弱电解质、强电解质、单质、气体等。
本题难度:简单