时间:2021-06-11 05:35:36
1、选择题 将0.01mol相同颗粒大小的镁粉、铁粉分别加入到盛有50mL1mol?L-1硫酸的两烧杯甲和乙中,如图能正确反映实验结果的是
( )
A.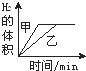
B.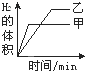
C.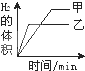
D.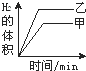
参考答案:n(H2SO4)1mol/L×0.05L=0.05mol,镁和铁分别与稀硫酸反应的方程式为:Mg+H2SO4=MgSO4+H2↑,Fe+H2SO4=FeSO4+H2↑,根据方程式知稀硫酸有剩余;
镁比铁活泼,所以镁和相同浓度的稀硫酸反应时,镁的反应速率大于铁反应的速率,则镁反应需要的时间短;
根据方程式知,同物质的量的镁和铁分别与足量稀硫酸反应生成的氢气体积相同,
故选A.
本题解析:
本题难度:简单
2、选择题 用一定量的铁与足量的CuO制单质铜,有人设计了以下两种方案:
①Fe H2
H2 Cu?②CuO
Cu?②CuO CuSO4
CuSO4 Cu
Cu
若按实验原则进行操作,则两者制得单质铜的量
A.一样多
B.①多
C.②多
D.无法判断
参考答案:C
本题解析:分析:写出两个方案中所发生的反应的化学方程式,根据质量守恒定律及氢气还原氧化铜的实验步骤进行分析解答.
解答:两方案中所发生的化学方程式为:①Fe+H2SO4═FeSO4+H2↑;H2+CuO ?Cu+H2O;
?Cu+H2O;
②CuO+H2SO4═CuSO4+H2O;Fe+CuSO4═Cu+FeSO4;
方案①中氢气还原氧化铜实验,开始时需先通入一部分氢气,排除装置中的空气,实验结束时还要通一会氢气,以防止生成的铜被氧化,如果不考虑先通后停,相同质量的铁生成铜的质量是相同的,但是由于部分氢气被浪费,从而导致铁的质量被多消耗一部分,所以导致方案①对应的铜减少.故方案②生成的铜多,分析选项可知选项C是正确的;
故选 C.
点评:本题考查了制备物质的不同途径中,方案不同,产物不同;生成产物的量的多少由反应物决定,参加反应的物质要根据实验过程实际用量进行确定.
本题难度:简单
3、选择题 将15.6g?Na2O2和5.4g?Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是( )
A.反应过程中得到6.72L(标准状况)的气体
B.最终无沉淀生成
C.最终得到的溶液中c(NaCl)=1.5mo/L
D.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
参考答案:15.6gNa2O2的物质的量为15.6g78g/mol=0.2mol,5.4gAl的物质的量为5.4g27g/mol=0.2mol,6.72LHCl气体的物质的量为6.72L22.4L/mol=0.3mol.
所发生的有关反应为2Na2O2+2H2O═4NaOH+O2↑;2Al+2H2O+2NaOH═2NaAlO2+3H2↑;HCl+NaOH═NaCl+H2O,NaAlO2+HCl+H2O═Al(OH)3↓+NaCl.
2Na2O2+2H2O═4NaOH+O2↑
0.2mol?0.4mol?2.24L?
2Al+2H2O+2NaOH═2NaAlO2+3H2↑
0.2mol?0.2mol?0.2mol? 6.72L
A、反应中共得到气体的体积为2.24L+6.72L=11.2l,故A错误;
B、将15.6gNa2O2和5.4gAl同时放入一定量的水中,反应后溶液的成分为0.2molNaOH和0.2molNaAlO2,加入0.3molHCl,反应后溶液的成分是0.3molNaCl和0.1molNaAlO2,生成0.1mol氢氧化铝沉淀,故B错误;
C、反应后溶液的成分是0.3molNaCl和0.1molNaAlO2,所以c(NaCl)=0.3mol0.2L=1.5mo/L,故C正确;
D、反应后溶液的成分是0.3molNaCl和0.1molNaAlO2,由电荷守恒可知c(Na+)=c(Cl-)+c(OH-)+c(AlO2-)-c(H+)
,故D错误.
故选:C.
本题解析:
本题难度:一般
4、选择题 将一定质量的Mg和Al的混合物投入2.0mol/L,250 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示。则下列说法正确的是(?)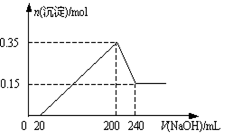
A.当加氢氧化钠溶液体积为20mL时,溶液的pH值等于7
B.当加氢氧化钠溶液体积为20mL时,溶液中的溶质只有硫酸镁和硫酸铝
C.NaOH溶液的物质的量浓度为5 mol/L
D.生成的H2在标准状况下的体积为11.2 L
参考答案:C
本题解析:A错,当加氢氧化钠溶液体积为20mL时,溶液中溶质为硫酸镁、硫酸铝、硫酸钠,溶液的PH小于7;B错,当加氢氧化钠溶液体积为20mL时,溶液中溶质为硫酸镁、硫酸铝、硫酸钠;C正确,当加入氢氧化钠溶液体积为200mL时,氢氧化钠全部生成硫酸钠,已知硫酸的物质的量为0.5mol,所以氢氧化钠的物质的量为1mol,得NaOH溶液的物质的量浓度为5 mol/L;D错,氢氧化铝的物质的量为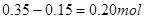 ;氢氧化镁的物质的量为0.15mol,由镁、铝守恒得镁的物质的量为0.15 mol,铝的物质的量为0.20mol;即生成氢应为0.45mol,生成的H2在标准状况下的体积为10.08 L;
;氢氧化镁的物质的量为0.15mol,由镁、铝守恒得镁的物质的量为0.15 mol,铝的物质的量为0.20mol;即生成氢应为0.45mol,生成的H2在标准状况下的体积为10.08 L;
本题难度:一般
5、填空题 现有一块已知质量为56.4g的铝镁合金,欲测定其中镁的质量分数,两位同学设计了不同的实验方案。
实验设计1:铝镁合金 测定生成气体的体积为69.44L(标准状况)
测定生成气体的体积为69.44L(标准状况)
实验设计2:铝镁合金  过滤,测定沉淀的质量为5.8g
过滤,测定沉淀的质量为5.8g
(1)写出实验方案2中反应②的离子方程式?
______________________________________________________________________?
(2)实验方案1中镁的质量分数为?
(3)请你设计第三种测定镁的质量分数的实验方案(表示方式同上)
?
参考答案:(1) Mg2+ + 2OH- = Mg(OH)2↓(2分) Al3+ + 4OH- = [Al(OH)4]-(2分)
(2)4.25﹪或4.26﹪或4.3﹪(4分)
NaOH溶液
(3)镁铝合金————→剩余固体的质量(或生成氢气的体积)(2分)
本题解析:(1) 实验方案2中的化学方程式为:
①加足量盐酸时,2Al+6HCl=2AlCl3+3H2↑? Mg+2HCl=MgCl2+ H2↑
②加过量NaOH溶液时,AlCl3+4NaOH =3NaCl+Na[Al(OH)4]? MgCl2+2NaOH =2NaCl+Mg(OH)2↓
再改写成离子方程式即可;
(2)27n(Al)+24n(Mg)="56.4g" ①
2Al+6HCl=2AlCl3+3H2↑? Mg+2HCl=MgCl2+ H2↑
2? 3? 1? 1
n(Al)? 1.5 n(Al)? n(Mg)? n(Mg)
1.5 n(Al)+ n(Mg)="3.1mol" ②
联立①②,得:n(Al)="2mol" ,n(Mg)=0.1mol
则实验方案1中镁的质量分数为:2.4g/56.4g=4.25﹪或4.26﹪或4.3﹪
(3)思路:镁铝合金中只有铝能与NaOH溶液生成氢气,剩余的固体为镁
本题难度:一般