时间:2021-02-18 07:32:14
1、简答题 用18mol?L-1浓硫酸配制100mL3.0mol?L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸③溶解 ④转移、洗涤 ⑤定容、摇匀
完成下列问题:
(1)所需浓硫酸的体积是______,量取浓硫酸所用的量筒的规格是______(从下列中选用A.10mL B.25mL C.50mL D.100mL).
(2)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)?
A.所用的浓硫酸长时间放置在密封不好的容器中______
B.容量瓶用蒸馏洗涤后残留有少量的水______
C.所用过的烧杯、玻璃棒未洗涤______?
D.定容时俯视刻度线______?
参考答案:(1)根据稀释定律,稀释前后溶质硫酸的物质的量不变,令需要浓硫酸的体积为V,则:
V×18mol?L-1=100mL×3.0mol?L-1
解得:V=16.7mL
需要量取浓硫酸16.7mL,故应选择25mL的量筒,
故答案为:16.7mL;B;
(2)A.浓硫酸具有吸水性,所用的浓硫酸长时间放置在密封不好的容器中,浓硫酸的浓度变稀,实际量取的浓硫酸中溶质硫酸的物质的量偏小,所配溶液的浓度偏小,
故答案为:偏小;
B.溶液配制需加水定容,容量瓶用蒸馏洗涤后残留有少量的水,对所配溶液浓度无影响,故答案为:无影响;
C.所用过的烧杯、玻璃棒未洗涤,少量硫酸沾在烧杯壁、玻璃棒上,移入容量瓶内硫酸的物质的量减少,所配溶液浓度偏小,故答案为:偏小;?
D.定容时俯视刻度线,导致液面在刻度线以下,溶液的体积偏小,所配溶液的浓度偏大,故答案为:偏大.
本题解析:
本题难度:简单
2、选择题 将10g由Mg、Zn、Fe组成的混合物与40mL稀硫酸恰好完全反应,产生的氢气在标准状况下为5.6L,则三种金属的物质的量之和为?(?)
A.0.5mol
B.0.25mol
C.0.1mol
D.0.125mol
参考答案:B
本题解析:Mg、Zn、Fe反应后均为二价即1mol(任何一种金属也可以是混合物)可置换出氢气1mol,5.6L标况氢气为5.6/22.4mol=0.25mol?则三种金属的物质的量之和为0.25mol。
点评:掌握相关金属与酸反应的计算技巧可快速解决此类问题。
本题难度:一般
3、选择题 向21.6g Fe粉和Cu粉的混合物中加入1L 1mol/L HNO3,充分反应,放出NO气体且金属有剩余。则反应后溶液中c(NO-3)为 (忽略溶液体积的变化)?(?)
(忽略溶液体积的变化)?(?)
A.0.45mol/L
B.0.6mol/L
C.0.75mol/L
D.0.9mol/L
参考答案:C
本题解析:略
本题难度:一般
4、填空题 (1)根据物质的量浓度的概念,可以求出纯水的物质的量浓度是______mol?L-
(2)氧气在空气中的体积分数约为0.25,则标况下,空气中氧气的物质的量的浓度是______mol?L-1.
(3)将一定量的MgCl2?溶于90g?水中,是每100个水分子中就有1个Cl-,这一定量的MgCl2的物质的量为______.
参考答案:(1)令水的体积为1L,水的质量为1000mL×1g/mL=1000g,水的物质的量为1000g18g/mol=55.5mol,故纯水的物质的量浓度为55.5mol1L=55.5mol/L;
故答案为:55.5;
(2)令空气的体积为1L,氧气的体积为1L×0.25=0.25L,氧气的物质的量为0.25L22.4L/mol=0.011mol,故空气中氧气的物质的量浓度为0.011mol1L=0.011mol/ L;
故答案为:0.011;
(3)90g水的物质的量为90g18g/mol=5mol,所以n(Cl-)=5mol100=0.05mol,根据氯离子守恒可知n(MgCl2)=12n(Cl-)=12×0.05mol=0.025mol;
故答案为:0.025.
本题解析:
本题难度:一般
5、选择题 等物质的量的氢气和氧气在标准状况下不相同的是(?)
A.分子数
B.质量
C.体积
D.原子数
参考答案:B
本题解析:根据阿伏加德罗定律可知,在相同条件下,相同体积的任何气体含有相同的分子数。又因为氢气和氧气都是由2个原子构成的,所以含有的原子数还是相同的。但由于二者的相对分子质量不同,所以它们的质量是不等的,答案选B。
点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式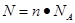 、n=m/M、
、n=m/M、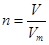 、
、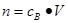 ,特别还要注意气体摩尔体积和阿伏加德罗定律的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
,特别还要注意气体摩尔体积和阿伏加德罗定律的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
本题难度:一般