时间:2021-02-18 07:29:26
1、实验题 (9分)如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。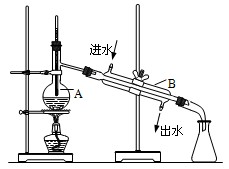
(1)图中有两处明显的错误是
①?②?
(2)A仪器的名称是?B仪器的名称是?
(3)实验时A中除加入少量自来水外,还需要加入少量的??,其作用是?(
参考答案:(1)(9分)①温度计水银球插入太深(2分)②冷却水进出口标反了(2分)
(2)?蒸馏烧瓶?(1分)?、?冷凝管?(1分)?
(3)?沸石(或碎瓷片)(1分)?、?防止液体暴沸(2分)
本题解析:(1)根据装置图可知,在蒸馏时温度计测量的是气体的温度,而不是液体的温度,因此温度计水银球应该放在蒸馏烧瓶的支管出口处;其次,冷却水的方向应该和气体的流向相反,即下口进,上口出。
(2)根据仪器的结构特点可知,A是蒸馏烧瓶,B是冷凝管。
(3)蒸馏时需要加热,所以在A中还需要加入碎瓷片,以防止暴沸。
本题难度:一般
2、填空题 (17分)过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,用作杀菌剂、防腐剂、解酸剂、油类漂白剂及封闭胶泥的快干剂,在食品、牙粉、化妆品等制造中用作添加剂。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。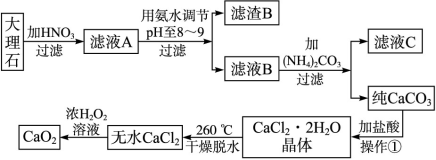
请回答下列问题:
(1)操作①中应包括?、?、?用氨水调节pH至8~9的目的是______________。
(2)若测得滤液C中c(CO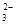 )=2.50×10-4 mol·L-1,则Ca2+_?_____(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
)=2.50×10-4 mol·L-1,则Ca2+_?_____(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH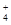 )?c(NO
)?c(NO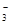 ) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为?。
) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为?。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式:_______________,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。用简要的文字解释需用氢氧化钠调节pH至9~11的原因_________________________。
(5)写出CaO2与H2O反应的化学方程式?。
参考答案:(1)溶解、过滤、蒸发结晶(3分);除去Fe3+或使Fe3+转化为Fe(OH)3沉淀被除去(2分)
(2)否(2分)
(3)<(2分)? c(NH4+)>c(CO32?)>c(OH?)>c(H+) (2分)
(4)CaCl2+H2O2 CaO2+2HCl(2分) 加入NaOH溶液使上述平衡向正反应方向移动,有利于CaO2沉淀的生成(2分)
CaO2+2HCl(2分) 加入NaOH溶液使上述平衡向正反应方向移动,有利于CaO2沉淀的生成(2分)
(5)2CaO2+2H2O=2Ca(OH)2+O2↑(2分)
本题解析:(1)沉淀碳酸钙用盐酸溶解然后蒸发结晶可以得到氯化钙晶体;因大理石中的主要杂质是氧化铁,它与硝酸反应生成了Fe(NO3)3,在调节pH到8~9时,Fe3+会以Fe(OH)3沉淀形式进入滤渣,从而除去了杂质离子Fe3+。
(2)根据离子积Ksp(CaCO3)=4.96×10-9=c(Ca2+)·c(CO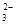 ),得c(Ca2+)=4.96×10-9/2.50×10-4 mol·L-1=1.98×10-5 mol·L-1 > 10-5 mol·L-1,没有沉淀完全。
),得c(Ca2+)=4.96×10-9/2.50×10-4 mol·L-1=1.98×10-5 mol·L-1 > 10-5 mol·L-1,没有沉淀完全。
(3)由电荷守恒:c(H+)+c(NH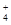 )=c(OH-)+c(NO
)=c(OH-)+c(NO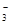 ),因c(H+)>c(OH-),故c(NH
),因c(H+)>c(OH-),故c(NH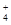 )<c(NO
)<c(NO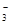 )。
)。
(4)由CaCl2+H2O2 CaO2+2HCl,加入NaOH溶液,NaOH与HCl发生中和反应,减少了生成物浓度,使上述平衡向正反应方向移动,有利于CaO2沉淀的生成。
CaO2+2HCl,加入NaOH溶液,NaOH与HCl发生中和反应,减少了生成物浓度,使上述平衡向正反应方向移动,有利于CaO2沉淀的生成。
(5)CaO2中O元素的化合价为—1价,部分化合价升高转化为O2,部分化合价降低转化为Ca(OH)2,所以化学方程式为:2CaO2+2H2O=2Ca(OH)2+O2↑
本题难度:困难
3、选择题 化学工作者从有机反应:RH+Cl2(g) RCl(l)+HCl(g)受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实。从上述反应产物中分离出盐酸的最佳方法是
RCl(l)+HCl(g)受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实。从上述反应产物中分离出盐酸的最佳方法是
(g表示物质为气态,l表示物质为液态)
[? ]
A.蒸馏法
B.水洗分液法
C.升华法
D.有机溶剂萃取法
参考答案:B
本题解析:
本题难度:简单
4、选择题 下列实验方法:①用升华法分离碘和砂子的混合物;②用分液法分离水和溴乙烷的混合物;③用蒸馏法分离酒精与苯酚(沸点为182℃)的混合物。你认为这些方法
A.①②正确
B.①③正确
C.②③正确
D.全部正确
参考答案:D
本题解析:略
本题难度:简单
5、选择题 V?L硫酸铝溶液中含Al3+的质量为m?g,则溶液中SO42-的物质的量浓度为
A.mol?L-1
B.mol?L-1
C.mol?L-1
D.mol?L-1
参考答案:B
本题解析:分析:硫酸铝的化学式为Al2(SO4)3,由n= 先计算Al3+的物质的量,由化学式中离子的关系可确定SO42-的物质的量,然后利用c=
先计算Al3+的物质的量,由化学式中离子的关系可确定SO42-的物质的量,然后利用c= 来计算SO42-的物质的量浓度.
来计算SO42-的物质的量浓度.
解答:Al3+的物质的量为 =
= mol,
mol,
由硫酸铝的化学式为Al2(SO4)3,
则SO42-的物质的量为 mol=
mol= mol,
mol,
则溶液中SO42-的物质的量浓度为 =
= mol?L-1,
mol?L-1,
故选B.
点评:本题考查物质的量浓度的计算,明确物质的量、体积、浓度的关系即可解答,本题的难点是利用铝离子的质量来计算离子的物质的量,将电子的质量忽略不计来分析解答.
本题难度:一般