时间:2021-02-18 07:26:47
1、填空题 请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷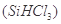 还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
还原法是当前制备高纯硅的主要方法,生产过程示意图如下: 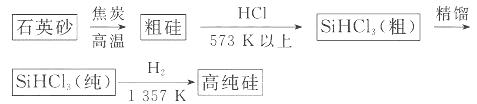
①写出由纯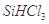 制备高纯硅的化学方程式: ____________________________________。
制备高纯硅的化学方程式: ____________________________________。
②整个制备过程必须严格控制无水无氧。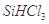 遇水剧烈反应生成
遇水剧烈反应生成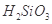 、HCl和另一种物质,配平后的化学反应方程式为___________________________;
、HCl和另一种物质,配平后的化学反应方程式为___________________________;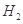 还原
还原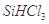 过程中若混入
过程中若混入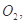 可能引起的后果是____________________________________。
可能引起的后果是____________________________________。
(2)下列有关硅材料的说法正确的是_________ (填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,振荡。写出实验现象并给予解释?。
参考答案:(1)①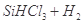
 Si+3HCl
Si+3HCl
②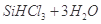

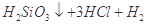 ↑ 发生爆炸
↑ 发生爆炸
(2)BC
(3)有白色胶状沉淀生成,反应原理为 Na2SiO3 + 2HNO3 = H2SiO3↓+ 2NaNO3
本题解析:(1)①根据原子守恒即质量守恒可以写出SiHCl3与H2反应的化学方程式。
②SiHCl3和H2O剧烈反应生成H2SiO3、HCl和另一种物质,分析它们化合价的变化可知,  ,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必定降低,即另一种物质是H2。
,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必定降低,即另一种物质是H2。
(2)SiC和Si3N4均为原子晶体,熔点高,性质稳定,A、B正确。光导纤维的材料为SiO2,C正确。玻璃是一种玻璃态物质,无固定的熔点。盐酸不能与硅反应,而HCl在573 K以上的温度下可与硅发生反应。因此D、E都不正确。
(3)有白色胶状沉淀生成,HNO3的酸性大于硅酸,所以发生反应:Na2SiO3 + 2HNO3 = H2SiO3↓+ 2NaNO3。
本题难度:一般
2、填空题 (14分)近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:① 2 CH4 (g) + 3O2 (g) = 2 CO (g) + 4 H2O(l) ?△H1 =-1214.6 KJ/mol
② 2 CO (g) + O2(g) =2 CO2 (g) ?ΔH2 = -566 kJ/mol
则反应CH4(g) + 2 O2 (g) =CO2 (g) + 2 H2O (l) 的△H=?。
(2)将两个石墨电极插人KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是:CH4 + 10 OH―― 8e-=CO32-+ 7 H2O;通入O2的一极,其电极反应式是?。
(3)若用石墨做电极电解500 ml饱和食盐水,写出电解反应的离子方程式为:??;电解一段时间后两极共收集到标准状况下的气体1.12 L(不考虑气体的溶解)。停止通电,假设反应前后溶液体积不变,则所得溶液的pH=?。
(4)将不同量的CO (g) 和H2O (g) 分别通入到体积为2 L的恒容密闭容器中,进行反应
CO (g) +H2O (g)  CO2 (g) +H2 (g),得到如下三组数据:
CO2 (g) +H2 (g),得到如下三组数据:
| ?实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
参考答案:(1)△H=-890.3KJ/mol
(2)O2 + 4e_+ 2H2O = 4OH-
(3)2Cl- + 2H2O? ?H2↑ + Cl2↑ + 2OH-;13
?H2↑ + Cl2↑ + 2OH-;13
(4)① 0.16 mol / (L?min)
② 0.17
③ 放
④ b = 2a
本题解析:(1)由盖斯定律得:△H=(△H1+ ΔH2)/2=(-1214.6-566)/2=-890.3KJ/mol
(2)CH4的一极发生氧化反应,O2的一极发生还原反应,碱性环境,得电子,生成氢氧根,所以O2 + 4e_+ 2H2O = 4OH-
(3)电解食盐水,阳极Cl-发生氧化反应生成,阴极H+发生还原反应,生成,所以2Cl- + 2H2O? ?H2↑ + Cl2↑ + 2OH-,标准状况下产生气体1.12 L,0.05mol,H2和Cl2各0.025mol,OH-即为0.05mol,所以OH-浓度为0.1mol/L,所以pH=13
?H2↑ + Cl2↑ + 2OH-,标准状况下产生气体1.12 L,0.05mol,H2和Cl2各0.025mol,OH-即为0.05mol,所以OH-浓度为0.1mol/L,所以pH=13
(4)① υ(CO)=(4-2.4)/2×5=1.6mol / (L?min)
②K=0.4×0.4/1.6×0.6=0.17
③对比1和2的平衡常数,2的小,平衡左移,所以升高温度,平衡左移,故正反应为放热反应。
④等效平衡,恒温恒容,又是反应前后气体体积数不变的反应,所以经一边倒后,只要物质的量成比例即可。
本题难度:简单
3、选择题 将CO2转化成有机物可有效实现碳循环。下列反应中,最节能的是
A.CO2 + 3H2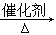 CH3OH +H2O
CH3OH +H2O
B.6CO2 + 6H2O C6H12O6 + 6O2
C6H12O6 + 6O2
C.CO2 + CH4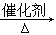 CH3COOH
CH3COOH
D.2CO2 + 6H2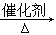 CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
参考答案:B
本题解析:光合作用是自然界中碳循环的反应,不需要再人为提供能源,所以是最好、最节能的,因此答案选B。
本题难度:简单
4、选择题 能与人体血液中的血红蛋白结合的一种有毒气体是
[? ]
A.氯气
B.氮气
C.甲烷
D.一氧化碳
参考答案:D
本题解析:
本题难度:简单
5、选择题 普通玻璃的主要成分是:
①Na2SiO3?②CaCO3?③CaSiO3?④SiO2?⑤Na2CO3?⑥CaO
A.①③⑥
B.②③④
C.①③④
D.③④⑤
参考答案:C
本题解析:普通玻璃是由纯碱、石灰石和石英为原料,主要发生Na2CO3+SiO2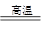 Na2SiO3+CO2和CaCO3+SiO2
Na2SiO3+CO2和CaCO3+SiO2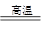 CaSiO3+CO2制得的,因此主要成分是硅酸钠、硅酸钙和二氧化硅。答案选C。
CaSiO3+CO2制得的,因此主要成分是硅酸钠、硅酸钙和二氧化硅。答案选C。
点评:本题非常基础,难度小。
本题难度:简单