时间:2021-02-18 07:17:06
1、选择题 在含有70克N2,128克O2和44克CO2的混和气体(标准状况)中,氮气所占体积百分比为
A.29.3%
B.33.3%
C.36%
D.50%
参考答案:B
本题解析:70克N2,128克O2和44克CO2的物质的量分别为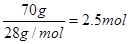 、
、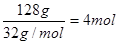 、
、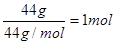 。因为在相同条件下,体积之比就是物质的量之比,所以氮气所占体积百分比为
。因为在相同条件下,体积之比就是物质的量之比,所以氮气所占体积百分比为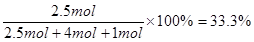 ,即选项B正确。
,即选项B正确。
本题难度:一般
2、选择题  关于反应2NaBr + Cl2 ="=" 2NaCl + Br2,下列说法不正确的是
关于反应2NaBr + Cl2 ="=" 2NaCl + Br2,下列说法不正确的是
A.Cl2是氧化剂,反应中Cl原子得到电子
B.当1molCl2完全反应时,有2mol电子发生转移
C.NaBr是还原剂,反应中溴离子得到电子
D.当1molNaBr完全反应时,有1mol电子发生转移
参考答案:C
本题解析:该反应中NaBr中Br失电子,化合价升高,从-1→0。
本题难度:一般
3、选择题 化学用语是学习化学的工具和基础。下列有关化学用语的使用正确的是?(?)
A.用食醋除去水壶内的水垢:CaCO3+2H+ = Ca2++CO2↑+H2?O
B.表示HS-电离的方程式为:HS-+H2O  S2-+H3O+
S2-+H3O+
C.用两个铁电极电解氢氧化钠溶液:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)= 2H2O(1);△H = +571.6 KJ·mol-1
参考答案:B
本题解析:醋酸是弱电解质,应该用化学式表示,A不正确;C不正确,铁做阳极时,铁失去电子,发生氧化反应;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以选项D不正确,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住。
本题难度:简单
4、选择题 正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是
A.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
B.SiH4、PH3、HCl的稳定性逐渐增强
C.过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)所含官能团相同;两者互为同分异构体
D.Ca2+的结构示意图为,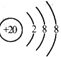 NH4Cl的电子式为
NH4Cl的电子式为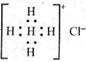
参考答案:B
本题解析:
选项A,前半句是对的,但是后半句不对,同素异形体必须是同种原子不同结构,这里四个物质结构相同,原子不同。
选项C,过氧乙酸的结构是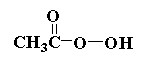 ,而羟基乙酸的结构是
,而羟基乙酸的结构是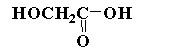 ,显然两者的官能团不一样,前者是酸酐,后者是羧酸根和羟基。
,显然两者的官能团不一样,前者是酸酐,后者是羧酸根和羟基。
选项D,前面钙离子的结构示意图正确,但是后面氯化铵的电子式不正确,正确的写法是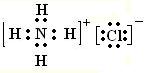
故排除后知B正确,得电子能力即电负性Si<P <Cl,所以键能Si-H<P-H <H-Cl,所以稳定SiH4<PH3 <HCl(共价分子稳定性由键能决定)。通俗的说法就是氧化性越强,氢化物越稳定。
本题难度:一般
5、选择题 浓硝酸与下列物质反应,其中硝酸既表现酸性又表现氧化性的是
A.Cu
B.C?
C.Fe2O3
D.Na2CO3
参考答案:A
本题解析:Fe2O3、Na2CO3与浓硝酸反应无化合价的改变,属于非氧化还原反应;而C被硝酸氧化后,硝酸全部被还原为NO2,只表现氧化性;而铜与浓硝酸反应时,部分硝酸被还原为NO2,部分硝酸形成了硝酸铜,故答案为D;
本题难度:一般