时间:2021-02-18 07:16:40
1、简答题 某同学为了验证氢气还原氧化铜的反应产物,设计了如图所示的实验装置.
(1)写出编号仪器的名称:①______,②______.
(2)浓硫酸的作用是______.
(3)本实验需要加热的装置为______(填字母编号).
(4)写出装置C、D中可观察到的现象:C______,D______.
(5)D中反应每生成1个水分子,转移的电子数为______.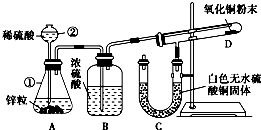
2、实验题 (13分)硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置)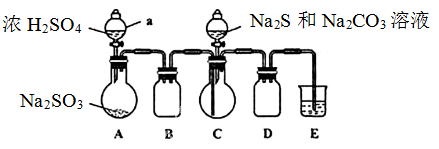
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是____;E中的试剂是___(选填下列字母编号)。
A.稀H2SO4? B.NaOH溶液? C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经____(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验步骤(2)进行了改进,改进后的操作是_______。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过_____方法提纯。
3、实验题 某化学课外活动小组在实验室设计了如下图所示的实验装置,进行“氨的催化氧化”实验。 
(1)A中制取气体时只用了一种药品,则该药品最好是______________(填化学式),图中空白处所需仪器应为____________________(选填下列仪器编号,固定装置省略)。 
(2)该装置补充完整后,仍然存在一定缺陷,试从安全与环保的角度来考虑,对该装置进行改进①__________________________;?②________________________________。
(3)按照改进后的装置进行实验,请完成以下问题: ?
①装置B的作用_______________________________________; ?
②写出C中发生反应的化学方程式:______________________________;
③若A、B处试剂足量,则装置D中可以观察到的实验现象有_______________。
4、选择题 下列实验正确的是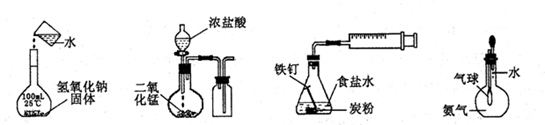
A.配制一定浓度溶液
B.制取并收集Cl2
C.铁的析氢腐蚀
D.验证氨气易溶于水
5、简答题 有一瓶硫酸钠溶液可能混有少量氯化钠,请设计实验方案检验溶液中氯化钠是否存在:______.