时间:2021-02-18 07:16:40
1、简答题 某同学为了验证氢气还原氧化铜的反应产物,设计了如图所示的实验装置.
(1)写出编号仪器的名称:①______,②______.
(2)浓硫酸的作用是______.
(3)本实验需要加热的装置为______(填字母编号).
(4)写出装置C、D中可观察到的现象:C______,D______.
(5)D中反应每生成1个水分子,转移的电子数为______.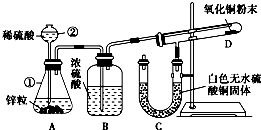
参考答案:(1)熟悉常见化学仪器,了解名称.图中①锥形瓶②长颈漏斗,故答案为:锥形瓶;长颈漏斗;
(2)氢气可用浓硫酸干燥,故答案为:干燥氢气;
(3)还原氧化铜的实验需要在高温下才可以进行,所以需要加热的装置字母编号为D,故答案为:D;
(4)C处得无水硫酸铜因吸水,由白色变为蓝色;D处得黑色氧化铜粉末在加热的条件下,被氢气还原成红色铜.颜色变化是由黑色变为红色.故答案为:白色固体变蓝;黑色粉末变红色;
(5)在反应CuO+H2?△?.?Cu+H2O中,化合价升高值=化合价降低值=转移电子数=2.故答案为:2.
本题解析:
本题难度:一般
2、实验题 (13分)硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置)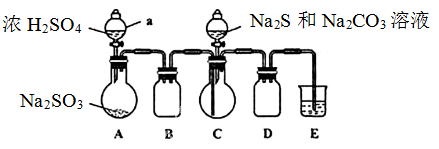
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是____;E中的试剂是___(选填下列字母编号)。
A.稀H2SO4? B.NaOH溶液? C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经____(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验步骤(2)进行了改进,改进后的操作是_______。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过_____方法提纯。
参考答案:Ⅱ.(1)分液漏斗;B?(3)蒸发
Ⅲ. (1)过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl。
(2)先向A中烧瓶滴加浓硫酸,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液。(3)重结晶
本题解析:Ⅱ.[制备产品]
(1)根据仪器的构造特点可知,仪器a的名称是分液漏斗。根据装置可知,A装置是制备SO2的,C装置是制备得Na2S2O3,BD装置是防倒吸的,由于SO2有毒,需要尾气处理,因此E装置是吸收SO2的。由于SO2是酸性氧化物,可以用氢氧化钠溶液吸收,即E中的试剂是氢氧化钠溶液,答案选B。
(3)由于Na2S2O3·5H2O是无色透明晶体,易溶于水,因此要从溶液中得到硫代硫酸钠晶体,责问需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)Na2S2O3·5H2O的稀溶液与BaCl2溶液混合无沉淀生成,而实验过程中有白色沉淀生成,因此要进一步验证,则可以向白色沉淀中滴加稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)由于亚硫酸盐易被氧化生成硫酸盐,而装置中含有空气,空气能氧化亚硫酸盐,所以为减少装置C中生成的Na2SO4的量,改进后的措施是先向A中烧瓶滴加浓硫酸,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液。
(3)由于Na2S2O3·5H2O的溶解度随温度升高显著增大,因此所得产品通过重结晶方法提纯。
本题难度:一般
3、实验题 某化学课外活动小组在实验室设计了如下图所示的实验装置,进行“氨的催化氧化”实验。 
(1)A中制取气体时只用了一种药品,则该药品最好是______________(填化学式),图中空白处所需仪器应为____________________(选填下列仪器编号,固定装置省略)。 
(2)该装置补充完整后,仍然存在一定缺陷,试从安全与环保的角度来考虑,对该装置进行改进①__________________________;?②________________________________。
(3)按照改进后的装置进行实验,请完成以下问题: ?
①装置B的作用_______________________________________; ?
②写出C中发生反应的化学方程式:______________________________;
③若A、B处试剂足量,则装置D中可以观察到的实验现象有_______________。
参考答案:(1)?NH4HCO3或(NH4)2CO3;e、f、g、h?
(2)①在装置C与D之间增加一个防倒吸装置;②在D后增加一个尾气吸收装置
(3)①吸收CO2和水蒸气,并生成O2;②4NH3+5O2 4NO+6H2O;③铜片逐渐减少直至溶解,溶液变蓝色,生成无色气体并在广口瓶上方变成红棕色
4NO+6H2O;③铜片逐渐减少直至溶解,溶液变蓝色,生成无色气体并在广口瓶上方变成红棕色
本题解析:
本题难度:一般
4、选择题 下列实验正确的是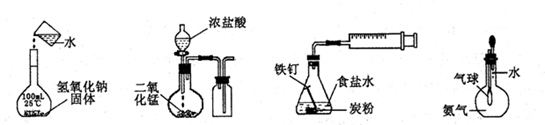
A.配制一定浓度溶液
B.制取并收集Cl2
C.铁的析氢腐蚀
D.验证氨气易溶于水
参考答案:D
本题解析:氢氧化钠固体不能直接倒入100mL容量瓶中溶解,应先在烧杯中溶解、冷却至25℃时,才能移入容量瓶中,且移液时一定要使用玻璃棒引流,故A错误;实验室常用二氧化锰和浓盐酸混合加热制取氯气,必须使用酒精灯加热,氯气的密度比空气大,必须用长进短出排气法收集,短进长出不能赶走集气瓶中的空气,故B错误;NaCl(食盐)是强酸强碱盐,食盐水呈中性,则铁、碳、中性电解质溶液形成原电池,发生吸氧腐蚀,在酸性环境中才可能发生析氢腐蚀,故C错误;氨气极易溶于水,瓶内气体压强迅速减小,瓶内外气体出现很大的压强差,若气球体积迅速增大,说明氨气易溶于水,故D正确。
本题难度:简单
5、简答题 有一瓶硫酸钠溶液可能混有少量氯化钠,请设计实验方案检验溶液中氯化钠是否存在:______.
参考答案:实验室用硝酸银溶液检验氯离子,但应首先排除硫酸根离子的干扰,可取少量溶液加入过量的硝酸钡溶液,充分反应后过滤,向滤液中滴加少量硝酸银溶液,如有白色沉淀产生,再加稀硝酸沉淀不溶解,说明有氯化钠存在.
故答案为:取少量溶液加入过量的硝酸钡溶液,充分反应后过滤,向滤液中滴加少量硝酸银溶液,如有白色沉淀产生,再加稀硝酸沉淀不溶解,说明有氯化钠存在.
本题解析:
本题难度:一般