时间:2021-02-18 07:16:19
1、实验题 实验室用 98%、密度为1.84g/cm3的浓硫酸配制0.2mol/L的 H2SO4溶液950mL.
(1)需要使用的主要仪器有量筒、烧杯、玻棒、 、 。
(2)其操作步骤可分解为以下几步:
A.用量筒量取 mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①完成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):
( D)→( A )→( C )→( )→( )→( )→( F )。
③容量瓶在使用前必须进行的操作是 。
④将浓硫酸在烧杯中稀释后移入容量瓶时,必须_____________方可移液.
(3)试分析下列操作对所配溶液的浓度有何影响
①量取浓硫酸时眼睛俯视刻度线,会导致所配溶液浓度会 ;(填: 偏高、偏低、或无影响,下同)
②定容时,眼睛俯视刻度线,所配溶液浓度会 ;
③定容后,加盖倒转摇匀后,发现溶面低于刻度线,又滴加蒸馏水至刻度,所配溶液浓度会 .
④容量瓶未干燥即用配制溶液 .
⑤往容量瓶转移时,有少量液体溅出 .
参考答案:(1)1000ml容量瓶 胶头滴管;(2)①10.9ml ;② B E G ;③检查是否漏液;④冷却到室温;(3)①偏低 ②偏高 ③偏低 ④无影响 ⑤偏低
本题解析:(1)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到1000mL容量瓶中,并用玻璃棒引流,洗涤后并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后盖好瓶塞颠倒摇匀.故所用仪器还有1000mL容量瓶、胶头滴管.
故答案为:1000mL容量瓶、胶头滴管.(2) 98%、密度为1.84g/cm3的浓硫酸的浓度为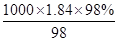 =18.4mol/L根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=1000mL×0.2mol/L,解得:x≈10.9,所以应量取的硫酸体积是10.9mL.故答案为:10.9.②配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到1000mL容量瓶中,并用玻璃棒引流,洗涤后并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后盖好瓶塞颠倒摇匀.所用操作顺序为D→A→C→B→E→G→F.
=18.4mol/L根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=1000mL×0.2mol/L,解得:x≈10.9,所以应量取的硫酸体积是10.9mL.故答案为:10.9.②配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到1000mL容量瓶中,并用玻璃棒引流,洗涤后并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后盖好瓶塞颠倒摇匀.所用操作顺序为D→A→C→B→E→G→F.
故答案为:B→E→G.③浓硫酸稀释放出大量热,溶液具有热胀冷缩的性质,未冷却到室温,趁热将溶液到入容量瓶,并配成溶液,会导致溶液体积偏小,溶液浓度偏大.故应将溶液冷却到室温后转移1000mL容量瓶中.故答案为:将溶液冷却到室温后(3)①量取浓硫酸时眼睛俯视刻度线,使量取硫酸溶液的体积偏低,所以溶液浓度偏低;故答案为:偏低.②定容时,眼睛俯视刻度线,使溶液的体积偏低,所配溶液浓度会偏高.故答案为:偏高.③摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所配溶液浓度会偏低.故答案为:偏低.
考点:溶液的配制
本题难度:一般
2、选择题 将标准状况下的aL氨气溶于1L水中,得到氨水的密度为bg?cm-3,则该氨水的物质的量浓度为( )
A.
| ab 22400 |
| ab 22400+17a |
| 1000ab 22400+17a |
| 1000ab 22400+35a |
参考答案:氨气的物质的量=aL22.4L/mol=a22.4mol;
氨气的质量=a22.4mol×17g/mol=17a22.4g;
氨水的体积=(17a22.4+1000)1000bL,则氨水的物质的量浓度=a22.4mol(17a22.4+1000)1000bL=1000ab22400+17amol/L,
故选C.
本题解析:
本题难度:一般
3、选择题 NA表示阿伏加德罗常数,下列计算关系正确的是
A.体积均为22.4L的N2和CO,所含分子数均为NA
B.1.7g H2O2中含有的电子数为0.9 NA
C.标准状况下,11.2L CCl4含有的分子数为0.5NA
D.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
参考答案:B
本题解析:A选项中,应用气体摩尔体积时,物质必须是气体,条件必须是标准状况,本选项没有提供,所以无法进一步求算。B选项中,1molH2O2含有18mol电子,1.7gH2O2的物质的量是0.05mol,这样电子数就是0.9 NA。C选项中,在标准状况下,CCl4是液体,所以不能用气体摩尔体积计算。D选项,稀有气体属于单原子分子,所以应该是22.4L。
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒
B.标准状况下,1.12 L的HCHO所含的原子数是0.2NA
C.1 L0.5mol·L-1Na2CO3溶液中含有的CO32-数目为0.5NA
D.0.1 mol Na2O2作供氧剂时转移的电子数目是0.2 NA
参考答案:B
本题解析:A、FeCl3与沸水不可能全部反应生成胶体,错误;B、标准状况下,1.12 L的HCHO所含的原子数是: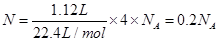 ,正确;C、CO32-会水解,错误;D、0.1 mol Na2O2作供氧剂时转移的电子数目是0.1 NA,错误。
,正确;C、CO32-会水解,错误;D、0.1 mol Na2O2作供氧剂时转移的电子数目是0.1 NA,错误。
本题难度:简单
5、选择题 下列关于1.5mol氢气的叙述中,正确的是( )
A.质量是4g
B.体积是33.6L
C.电子数是3
D.分子数是1.5×6.02×1023个
参考答案:A.质量为1.5mol×2g/mol=3g,故A错误;
B.不一定在标况,Vm未知,不能利用V=nVm计算体积,故B错误;
C.H的电子数为1,则电子数为1.5mol×2×1=3mol,故C错误;
D.由N=nNA可知,分子数是1.5×6.02×1023个,故D正确;
故选D.
本题解析:
本题难度:一般