时间:2021-02-18 07:15:37
1、选择题 可用离子方程式H++OH-=H2O表示的化学反应是( )
A.CH3COOH+NaOH=CH2COONa+H2O
B.2HNO3+Mg(OH)=Mg(NO3)2+2H2O
C.H2SO4+Ba2(OH)2=BaSO4↓+2H2O
D.2HCl+Ba(OH)2=BaCl2+2H2O
参考答案:A、CH3COOH+NaOH=CH2COONa+H2O的离子反应为CH3COOH+OH-=CH2COO-+H2O,故A不选;
B、2HNO3+Mg(OH)=Mg(NO3)2+2H2O的离子反应为2H++Mg(OH)=Mg2++2H2O,故B不选;
C、H2SO4+Ba2(OH)2=BaSO4↓+2H2O的离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故C不选;
D、2HCl+Ba(OH)2=BaCl2+2H2O的离子反应为H++OH-=H2O,故D选;
故选D.
本题解析:
本题难度:简单
2、选择题 下列叙述不正确的是
A.0.1mol/L的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
B.0.1mol/LNa2CO3溶液中:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
C.浓度均为0.1mol/L的碳酸钠溶液和氨水溶液中,由水电离出的c(OH-):前者大于后者
D.0.1mol/LNH4Cl和0.1mol/L NH3·H2O等体积混合溶液中pH>7,则:c(NH4+)>c(Cl-)>c(OH-)>c(NH3·H2O)>c(H+)
参考答案:D
本题解析:A.不正确,Na2S溶液使酚酞试液变红:S2-+H2O 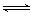 OH-+HS―
OH-+HS―
B.不正确,在醋酸溶液中加入Na2CO3溶液:CO32-+2CH3COOH=CO2↑+H2O2CH3COO―
C.不正确,NH4HCO3溶液与过量NaOH溶液混合:NH4++HCO3―+2OH-=NH3?H2O+CO32―+H2O
D.正确。
本题难度:一般
3、选择题 能正确表示下列反应的离子方程式为
A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-=CO32-+H2O
B.二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O
C.硫化钡加入稀硫酸:BaS+2H+=H2S↑+Ba2+
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
参考答案:B
本题解析:选项A,NaHCO3溶液与Ca(OH)2溶液反应一定生成CaCO3;选项B,在溶液中ClO-能将SO2氧化为SO42-;选项C,BaS与稀硫酸反应生成更难溶的BaSO4沉淀;选项D,在强碱溶液中,不可能生成H+。
本题难度:一般
4、填空题 (1)Mg(OH)2中混有的Al(OH)3的杂质可以用NaOH除去,请用离子方程式表示______
(2)Fe3+的检验用离子方程式表示______
(3)在配制硫酸亚铁溶液时,常常加入铁粉,请说明原因______(用离子方程式表示)
(4)硫化钠水溶液显______性(填酸、碱、中),原因______(用离子方程式表示)
(5)写出镁条在二氧化碳中燃烧的化学方程式______.
参考答案:(1)因氢氧化铝能溶解在NaOH溶液中,而氢氧化镁不能,Mg(OH)2中混有的Al(OH)3的杂质可以用NaOH除去的离子反应为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)利用KSCN溶液检验铁离子,溶液为血红色,离子反应为Fe3++3SCN- Fe(SCN)3或与碱反应生成红褐色沉淀,离子反应为Fe3++3OH-=Fe(OH)3,
Fe(SCN)3或与碱反应生成红褐色沉淀,离子反应为Fe3++3OH-=Fe(OH)3,
故答案为:Fe3++3SCN- Fe(SCN)3或Fe3++3OH-=Fe(OH)3;
Fe(SCN)3或Fe3++3OH-=Fe(OH)3;
(3)配制硫酸亚铁溶液时,常常加入铁粉,是因亚铁离子易被氧化,则加入铁发生2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(4)硫化钠水溶液中因硫离子水解使溶液显碱性,发生的离子反应为S2-+H2O HS-+OH-,故答案为:碱性;S2-+H2O
HS-+OH-,故答案为:碱性;S2-+H2O HS-+OH-;
HS-+OH-;
(5)Mg在二氧化碳中燃烧生成氧化镁和碳,发生的化学反应为2Mg+CO2点燃.2MgO+C,故答案为:2Mg+CO2点燃.2MgO+C.
本题解析:
本题难度:一般
5、选择题 下列离子方程式书写正确的是(?)
A.钠与硫酸铜溶液反应: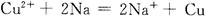
B铁屑溶于过量稀硝酸: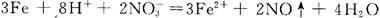
C.石灰石溶于醋酸: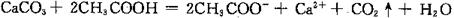
D.FeI2溶液中通人少量氯气: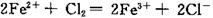
参考答案:C
本题解析:钠是活泼的金属,极易和水反应,在溶液中和硫酸铜反应得不到铜单质,A不正确;B中硝酸是过量的,应该生成硝酸铁,B不正确;碘离子的还原性强于亚铁离子的,所以氯气首先氧化的是碘离子,D不正确,答案选C。
点评:归判断离子方程式正确与否的方法一般是:(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式。
本题难度:一般