时间:2021-02-18 07:15:16
1、选择题 管道煤气的主要成分是H2、CO和少量的甲烷。相应的热化学反应方程式为:
2H2(g)+O2(g)==2H2O(l)
参考答案:
本题解析:
本题难度:一般
2、简答题 (14分)用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
(1) SiCl4的平均反应速率为___
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是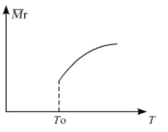
A.该反应在任何温度下可自发进行
B.若混合气体的总质量不变,表明上述反应己达到平衡状态
C.其他条件不变,增大Si3N4的物质的量,平衡向左移动
D.按3:2:6的物质的量比增加反应物,SiC14(g)的转化率降低
(3)下表为不同温度下该反应的平衡常数,其他条件相同时,在___(填"T1”、“T2”.,“T3”)温度下反应达到平衡所需时间最长:
假设温度为T1时向该反应容器中同时加入。(SiC14) =0.3 mol/L,c(H2) =0.3 mol/L,,c(N2) =
x mol/L, c (HCl) =0.3 mol/L和足量Si3N4 (s),若要使平衡建立的过程中HCl浓度减小,x的取值
范围为___
(4)该反应的原子利用率为____
(5)工业上制备SiCl4的反应过程如下: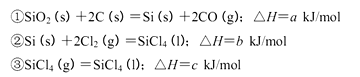
写出二氧化硅、焦炭与Cl 2在高温下反应生成气态SiC14和一氧化碳的热化学方程式_____
参考答案:(14分)
(1)0.015mol/(L?min)(2分) (2)AB(2分)
(3)T3(2分) 0 ≤ x < 0.15(3分) (4)24.22%(2分)
(5)SiO2(s)+2C(s)+2Cl2(g)=SiCl4(g)+2CO(g) ?H=(a+b-c)kJ?mol?1(3分)
本题解析:(1)反应生成的n(Si3N4)=2.8g÷140g/mol=0.02mol,则反应的SiCl4为:n(SiCl4)=3n(Si3N4)=3×0.02mol=0.06mol,则v(Si3N4)=0.06mol÷2L÷2min=0.015mol/(L?min)。
(2)正反应方向,气体的物质的量增大,气体的质量减小,根据图像可知温度升高,混合气体的平均相对分子质量增大,所以升温平衡向逆反应方向移动移动,则该反应为放热反应。A、因为该反应?H <0,?S>0,所以?H?—T?S恒小于0,在任何温度下可自发进行,正确;B、因为Si3N4为固体,反应前后气体的质量不相等,所以若混合气体的总质量不变,表明反应己达到平衡状态,正确;C、因为Si3N4为固体,所以其他条件不变,增大Si3N4的物质的量,对平衡无影响,错误;D、按3:2:6的物质的量比增加反应物,H2的体积分数增大,所以SiC14(g)的转化率增大,错误。
(3)该反应为放热反应,随着温度升高,平衡常数减小,所以T3温度最低,反应速率最小,达到平衡所需时间最长;当反应恰好达到平衡时,根据平衡常数可得:0.312÷(0.33×0.36×x2)=1.2,解得x=0.15mol,要使平衡建立的过程中HCl浓度减小,反应向左进行,所以0 ≤ x < 0.15
(4)根据化学方程式,原子的利用率=140÷(140+12×36.5)×100%=24.22%
(5)首先写出化学方程式并注明状态:SiO2(s)+2C(s)+2Cl2(g)=SiCl4(g)+2CO(g),然后根据盖斯定律求算焓变,该反应可由已知的3个反应经① + ②—③求得,所以?H=(a+b-c)kJ?mol?1,进而可写成化学方程式。
考点:本题考查化学反应速率、化学平衡、原子利用率、热化学方程式的书写。
本题难度:一般
3、填空题 镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g)=MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g)=Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) = 2Mg(s)+Mg2NiH4(s) △H3
则△H3 = kJ·mol-1。
(2)工业上可用电解熔融的无水氯化镁获得镁。其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4Cl·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 ;电解熔融氯化镁,阴极的电极反应式为 。
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:Mg(AlH4)2=MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为 。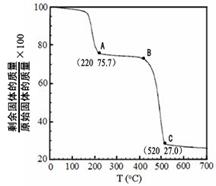
(4)工业上用MgC2O4·2H2O热分解制超细MgO,其热分解曲线如图。
图中隔绝空气条件下B→C发生反应的化学方程式为 。
(5)一种有机镁化合物可用于制造光学元件的涂布液,化学式可表示为: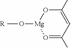 ,它可发生如下反应:
,它可发生如下反应:
ROH与B的核磁共振氢谱如下图: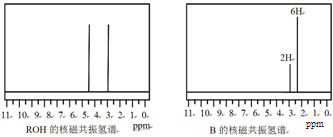
ROH由C、H、O、F四种元素组成的含氟有机物,分子中只有1个氧原子,所有氟原子化学环境相同,相对分子质量为168,则ROH的结构简式为 ; B的结构简式为 。
参考答案:
(1)+84.6(2分)。
(2)MgCl2·NH4Cl·nNH3 MgCl2 +(n+1)NH3↑ + HCl↑ (2分); Mg2++2e-= Mg(2分)。
MgCl2 +(n+1)NH3↑ + HCl↑ (2分); Mg2++2e-= Mg(2分)。
(3)3mol(2分)。(4)MgC2O4 MgO + CO↑+ CO2↑(2分)
MgO + CO↑+ CO2↑(2分)
(5)(CF3)2CHOH (2分);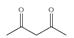 (2分)。
(2分)。
本题解析:(1)方程式②-①×2=-64.4-(-74.5)×2=+84.6 kJ·mol-1;(2)化合物分解得到无水氯化镁、氨气、和氯化氢;阴极阳离子放电;(3)该反应中只有铝元素化合价降低,由+3价到0价,生成1mol铝,电子转移3mol;(4)根据图数据计算分析,若总质量为148g,第一次分解产物质量为148×75.7%=112g,第二次分解产物的质量为148×27%=40g,所以A点生成MgC2O4,C点生成MgO;B→C发生反应为MgC2O4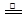 MgO + CO↑+ CO2↑;(5)根据信息含有1个羟基,图谱中显示物质中含有2中化学环境的氢且数目相同,即物质中只含有两个氢原子,其它全被氟取代,根据相对分子质量确定为(CF3)2CHOH。
MgO + CO↑+ CO2↑;(5)根据信息含有1个羟基,图谱中显示物质中含有2中化学环境的氢且数目相同,即物质中只含有两个氢原子,其它全被氟取代,根据相对分子质量确定为(CF3)2CHOH。
考点:考查STS中环境保护有关问题。
本题难度:困难
4、填空题 已知一些共价键的键能如下(单位:kJ/mol) H-H:436.4 Cl-Cl:242.7 H-C1:431.8
(1)写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式:______________________。
(2)若有1 g氢气在氯气中完全燃烧,可放出热量________________kJ。
参考答案:(1)H2(g)+Cl2(g) = 2HCl(g) △H= -184.5 kJ/mol
(2)92.25
本题解析:
本题难度:一般
5、选择题 火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:

则N2H4和NO2反应的热化学方程式为
[? ]




参考答案:D
本题解析:
本题难度:一般