时间:2021-02-18 07:14:56
1、选择题 下列物质溶于水能够导电,但属于非电解质的是
A.液氯
B.二氧化硫
C.硫酸
D.蔗糖
2、选择题 常温时,下列各组离子能大量共存的是
A.Ag+、K+、NO3ˉ、S2ˉ
B.Fe3+、NH4+、SO42ˉ、NO3ˉ
C.Fe2+、Na+、Clˉ、ClOˉ
D.H+、Clˉ、SO42ˉ、AlO2ˉ
3、填空题 某河道两旁有甲、乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO3-六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________。
(2)乙厂的废水中含有另外三种离子。如果加一定量________(选填“活性炭”“铁粉”),可以回收其中的________(填写金属元素符号)。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的________(填写离子符号)转化为沉淀。经过滤后的废水主要含________,可用来浇灌农田。
4、填空题 (8分)现有A、B、C、D四种溶液,它们的阳离子和阴离子均各不相同,所含阳离子是:Ba2+、Ag+、H+、Na+,所含阴离子是:CO32—、NO3—、Cl—、OH-,为了确定这四种溶液成分,进行如下化学实验:
(1)A与B混合后无现象
(2)B与D混合后产生气体
(3)B与C混合后产生沉淀
(4)A与D混合产生沉淀,该沉淀溶于B
(5)A与C混合产生沉淀
| ? | A | B | C | D |
| A | ? | — | ↓ | ↓ |
| B | — | ? | ↓ | ↑ |
| C | ↓ | ↓ | ? | ? |
| D | ↓ | ↑ | ? | ? |
5、选择题 下列有关物质检验的实验结论正确的是
| ? | 实验操作 | 现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有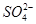 |
| B | 将某气体通入澄清石灰水中 | 变浑浊 | 该气体一定是CO2 |
| C | 向某溶液中加入2滴KSCN溶液 | 溶液不显红色 | 溶液中一定含有Fe2+ |
| 另取样,先滴入氯水,再滴入KSCN溶液 | 溶液变为红色 | ||
| D | 将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热 | 有银镜生成 | 该物质一定是葡萄糖 |