时间:2021-02-18 07:14:15
1、选择题 将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性减小
D.甲、乙溶液均变蓝
参考答案:A、甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B、乙中不构成原电池,铜片不是电极,故B错误;
C、甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,故C正确;
D、甲、乙装置中铜都不参加反应,所以甲、乙溶液都不变蓝,故D错误;
故选C.
本题解析:
本题难度:一般
2、选择题 日本茨城大学研制了一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性。电池总反应为:CH3OCH3 +3O2=2CO2 +3H2O ,电池示意如图,下列说法不正确的是:
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ ?+ O2 + 4e- = 2H2O
D.电池工作时,1mol二甲醚被氧化时就有6mol电子转移
参考答案:D
本题解析:由总反应可知,氧气得电子,做正极,二甲醚失电子,做负极,电子经导线流向b极,电流方向恰好相反,由b极流向a极。
氧气在正极得电子时,结合自负极提供的质子,即:4H+ ?+ O2 + 4e- = 2H2O
由总反应可看出,1mol二甲醚被氧化时就有12mol电子转移
故选项D符合题意
本题难度:一般
3、选择题 某准晶体W由一定比例的铁、铜、铝组成。取两块该准晶体:一块投入烧杯①中,注入浓氢氧化钠溶液浸没固体;另一块投入烧杯②中,注入稀硫酸浸没固体。下列分析合理的是
A.在烧杯①中,若构成微型电池,负极反应式为2Al-6e-=2Al3+,正极反应式为:6H2O+6e-=6OH-+3H2↑
B.在烧杯②中,若铁、铜构成微型电池,则铁为负极;若铝、铁构成微型电池,则铁为正极
C.在烧杯①中,若构成微型电池,铁为负极,铜为正极,正极反应式为2H2O+2e-=2OH-+H2↑
D.在烧杯②中,固体最终完全溶解,溶液呈蓝色。向溶液中滴加KSCN溶液,溶液不变色
参考答案:B
本题解析:A、在烧杯①中,若构成微型电池,电解质溶液为氢氧化钠,铝能与氢氧化钠溶液反应,因此铝是负极,电极反应式为2Al-6e-+8OH-=2AlO2-+4H2O,A错误;B、原电池中较活泼金属为负极,则在烧杯②中,若铁、铜构成微型电池,铁为负极;若铝、铁构成微型电池,铁为正极,B正确;C、在烧杯①中,若构成微型电池,只有铝能与氢氧化钠反应,则铝为负极,C错误;D、稀硫酸与铜不反应,不可能生成硫酸铜,D错误,答案选B。
考点:考查原电池原理的应用
本题难度:一般
4、选择题 如下图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O 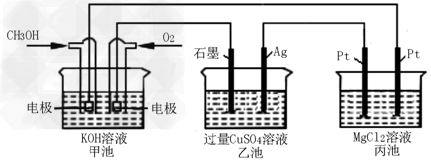
下列说法正确的是
[? ]
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗280mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
参考答案:D
本题解析:
本题难度:一般
5、计算题 由铜片、锌片与200 mL硫酸组成的原电池中,若锌片只发生电化学腐蚀,则当在铜片上共放出0.15 mol气体时,H2SO4恰好全部用完。产生这些气体消耗锌多少克?所用硫酸的物质的量浓度是多少?
参考答案:9.75 g? 0.75 mol·L-1
本题解析:此反应的总反应是
Zn? +? 2H+? ="===?" Zn2+? +? H2↑
65 g? 2 mol? 1 mol
x? y? 0.15 mol
x=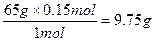 ? y=
? y= ?mol
?mol
H2SO4的物质的量为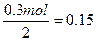 ?mol
?mol
c(H2SO4)= ?mol·L-1
?mol·L-1
本题难度:简单