时间:2021-02-18 07:13:08
1、选择题 下列说法中正确的是(?)
A.凡是放热反应都是自发的,由于吸热反应都是非自发的
B.自发反应在恰当条件下才能实现
C.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
D.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
参考答案:B
本题解析:A项,化学反应能否自发进行由△H+T△S决定。A项,错误;B项,正确。 催化剂通过影响反应的活化能进而增大单位体积内的活化能分子数,影响化学反应速率,C项,错误。增大反应物浓度,可增大单位体积内活化分子的个数,D项错误。
本题难度:一般
2、选择题 进行如下实验,在A锥形瓶中放入10 g绿豆大小的碳酸钙,在B锥形瓶中放入5 g粉末状的碳酸钙,分别加入50 mL 1 mol·L-1盐酸,下图中能正确表示实验结果的是(注:x—时间,y—锥形瓶中碳酸钙减少的质量)( )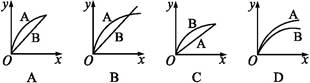
参考答案:C
本题解析:有固体参加的反应速率与固体表面积有关。B锥形瓶中放入粉末状的碳酸钙,所以B中产生的CO2速率比较大;50 mL 1 mol·L-1盐酸最多只能消耗碳酸钙2.5 g,最终产生的CO2应该相等,故C选项的图像符合。
考点:影响化学反应速率的因素
本题难度:一般
3、简答题 为了研究外界条件对H2O2分解速率的影响,某同学做了以下实验,请回答下列问题.
| 编号 | 操作 | 实验现象 ① 分别在试管A、B中加入5mL5%H2O2溶液,各滴入2滴1mol/LFeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. 试管A中产生气泡量减少;试管B中产生的气泡量增大. ② 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2溶液 试管A、B中均未明显见到有气泡产生. |

参考答案:(1)氯化铁作催化剂条件下,双氧水迅速分解生成氧气和水,反应方程式为:2H2O2 FeCl3. 2H2O+O2↑,
故答案为:2H2O2FeCl3. 2H2O+O2↑;
(2)分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现,说明过氧化氢分解能发生,试管A、B中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中,两支试管不同点是试管A的温度比试管B的温度低,说明研究的是温度对反应速率的影响,
故答案为:研究温度对H2O2分解速率的影响;
(3)影响化学反应速率的外界因素有浓度、温度、气体的压强、催化剂、固体的表面积,另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液,试管A、B中均未见气泡产生,为加快反应速率,可从温度、催化剂的影响角度考虑,
故答案为:将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率;
(4)该图象横坐标表示时间,纵坐标表示生成气体的体积,时间越短生成的气体越多,反应速率越快,所以速率最慢的为C,最快的为A,故答案为:A;
(5)①至于定性分析可以根据产生气泡的速率来进行判断反应的快慢;为比较Fe3+和Cu2+对H2O2分解的催化效果,要保持其它条件相同,而FeCl3溶液中还有氯离子,CuSO4中含有铜离子,因此氯离子可能也会影响反应速率,产生干扰,所以可将FeCl3改为Fe2(SO4)3,
故答案为:溶液中气泡产生的速率;排除氯离子的干扰(合理即可);
②若定量分析反应的快慢可以测定收集40mL的气体所需的时间,时间短则反应快,故答案为:收集40mL气体所需的时间.
本题解析:
本题难度:一般
4、选择题 对于100mL 1mol/L盐酸与锌粒的反应,下列措施能使反应速率加快的是
[? ]
①升高温度 ②改用100mL 3mol/L盐酸 ③改用300mL 1mol/L盐酸 ④用等量锌粉代替锌粒
A. ①③④
B. ①②④
C. ②③④
D. ①②③
参考答案:B
本题解析:
本题难度:一般
5、选择题 下图曲线a表示放热反应X(g)+Y(g)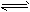 Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
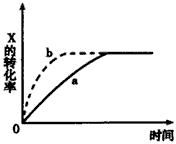
[? ]
参考答案:C
本题解析:
本题难度:一般