时间:2021-02-18 07:12:26
1、选择题 在一定温度下,可逆反应X(g)+3Y(g) 2Z(g)达到平衡的标志是(?)
2Z(g)达到平衡的标志是(?)
A.X、Y、Z的浓度不再变化
B.单位时间生成a mol X,同时生成3a mol Y
C.X、Y、Z的分子数比为1∶3∶2
D.Z生成的速率与X生成的速率相等
参考答案:A
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以A正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,C不正确。B中反应的方向是相同的,不正确。D中反应的方向相反,但不满足反应速率之比是相应的化学计量数之比,所以答案选A。
本题难度:一般
2、选择题 向甲、乙两个容积均为1 L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2 mol SO2、1 mol O2,乙充入1 mol SO2、0.5 mol O2),发生反应:2SO2(g)+O2(g)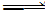 2SO3(g);ΔH=-197.74 kJ·mol-1。
2SO3(g);ΔH=-197.74 kJ·mol-1。
一段时间后达到平衡,测得两容器中c(SO2)(mol·L-1)随时间t(min)的变化关系如右图所示。下列说法正确的是( )
A.热量:Q(甲)<2Q(乙)
B.压强:p(甲)<2p(乙)
C.乙中前5 min内的反应速率v(O2)=0.10 mol·L-1·min-1
D.保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2 mol O2、0.4 mol SO3,则此时v(正)<v(逆)
参考答案:BD
本题解析:A、两容器反应若为等效平衡,则产生的热量Q(甲)=2Q(乙),但容器乙中物质的量少,压强低平衡逆向移动,产生的热量少,故有Q(甲)>2Q(乙),错误;B、同A,相对于甲容器,乙容器压强低,平衡逆向移动,气体总物质的量变多,压强变大,正确;C、乙中前5 min内的反应速率v(O2)=1/2v(SO2)=0.05mol·L-1·min-1,错误;
2SO2(g)+O2(g)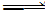 2SO3(g)
2SO3(g)
始量? 1? 0.5? 0
转化量? 0.5? 0.25 ?0.5
平衡量? 0.5? 0.25? 0.5
该反应的平衡常数k=0.52÷(0.52×0.25)=4
此时Q=0.42÷(0.42×0.2)=5>k,平衡逆向移动,正确。
本题难度:一般
3、选择题 在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl- [CuCl4]2-(绿)+4H2O能使黄绿色CuCl2溶液向蓝色转化的操作是
[CuCl4]2-(绿)+4H2O能使黄绿色CuCl2溶液向蓝色转化的操作是
A.蒸发浓缩
B.加CuCl2固体
C.加入AgNO3
D.加入食盐晶体
参考答案:C
本题解析:使黄绿色CuCl2溶液向蓝色转化,即平衡左移,加入AgNO3,可以减小氯离子浓度,平衡左移。蒸发浓缩、加入氯离子均使平衡右移。
本题难度:简单
4、选择题 同时向五个温度不同、容积相同的恒容密闭容器中,分别加入等量的原料气(SO2和O2),发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。经过相同的反应时间后,分别测定五个容器中SO2的转化率(α),并作出其随反应温度(T)变化的关系图。下列示意图中,不可能与实验结果相符的是(? )
2SO3(g) ΔH<0。经过相同的反应时间后,分别测定五个容器中SO2的转化率(α),并作出其随反应温度(T)变化的关系图。下列示意图中,不可能与实验结果相符的是(? )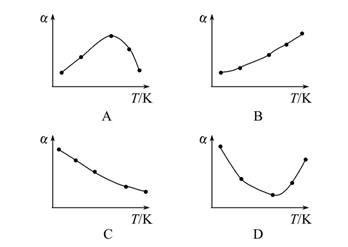
参考答案:D
本题解析:因为五个容器的体积相同,温度不同,则温度高的反应速率快,温度低的反应速率慢,温度高的反应先达到平衡状态。在容器中发生反应可能存在的情况有下列几种:(1)五个容器中都没有达到平衡状态。则温度高的反应速率快,SO2的转化率高,B项符合。(2)五个容器中早已达到平衡,则升高温度平衡向逆反应方向移动,温度越高,平衡向逆反应方向进行的程度越大,SO2的转化率越小,C项符合。(3)五个容器中有的已经达到平衡, 有的没有达到平衡。则温度低的没有达到平衡,温度高的早已经达到平衡。没有达到平衡的温度越高,SO2的转化率越高,达到平衡的,温度越高,SO2的转化率越低,A项符合。只有D项与题意不符。
本题难度:一般
5、选择题 已知某物质颜色的强度与该物质的浓度成正比、与观察者的视程中的物质厚度成正比。在注射器中,存在NO2与N2O4的混合物,气体呈棕色,现将注射器的针筒慢慢往外拉,保持温度不变,此时混合物的颜色为
A.从针筒的顶端方向观察,气体颜色变深
B.从针筒的顶端方向观察,气体颜色变浅
C.从针筒的垂直方向观察,气体颜色没有变化
D.从针筒的垂直方向观察,气体颜色变深
参考答案:A
本题解析:NO2为红棕色气体,N2O4无色
对于可逆反应2NO2 N2O4,向外拉针筒时,相当于减压,平衡逆向移动,生成更多的NO2(但两物质的浓度是减小的)。
N2O4,向外拉针筒时,相当于减压,平衡逆向移动,生成更多的NO2(但两物质的浓度是减小的)。
故从针筒的顶端方向观察,NO2的浓度减小,但厚度增大,总体来说,气体颜色加深;但从针筒的垂直方向观察,NO2的浓度减小,厚度不变,气体的颜色变浅,答案为A
本题难度:一般