时间:2021-02-18 07:09:37
1、选择题 氢—氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:2H2+4OH--4e-===4H2O和O2+2H2O+4e-===4OH-?。则下列叙述正确的是:
A.通H2的一极是正极,通O2的一极是负极?
B.通O2的一极是正极,通H2的一极是负极
C.工作一段时间后电解质溶液pH增大?
D.工作时正极区附近pH减小?
参考答案:B
本题解析:略
本题难度:简单
2、填空题 能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)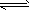 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g)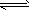 CH3OH(g) ΔH2
CH3OH(g) ΔH2
上述反应符合“原子经济”原则的是__________(填“Ⅰ”或“Ⅱ”),
(2)下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K) 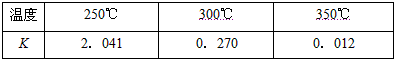
①由表中数据判断ΔH2_______0(填“>”、“<”或“=”),
②若容器容积不变,下列措施可增加甲醇产率的是______________,
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
E.按原比例再充入CO和H2
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=
0.2mol·L-1,则CO的转化率为____________,此时的温度为____________(从上表中选择);
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的原电池装置。 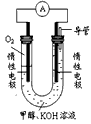
①该电池工作时,OH-向_______极移动(填“正”或“负”),
②该电池正极的电极反应式为___________________。
参考答案:(1)①Ⅱ
(2)①<;②BE;③80%;250℃
(3)①负;②O2+2H2O+4e-→4OH-
本题解析:
本题难度:困难
3、选择题
下图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子
(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2→2CO2
+4H2O。下列说法正确的是
参考答案:AC
本题解析:
本题难度:一般
4、选择题 科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
A.H2+2OH-=2H2O+2e-
B.O2+4H++4e-=2H2O
C.H2 -2e-=2H+
D.O2+2H2O+4e-=4OH-
参考答案:C
本题解析:
A、电解质溶液呈酸性,负极上无OH-离子参与反应,故A不合题意;
B、负极发生氧化反应,氢气失去电子,该反应为正极反应,故B不合题意;
C、电解质溶液呈酸性,则负极上氢气失电子生成氢离子,电极反应为H2=2H++2e-,故C符合题意;
D、负极发生氧化反应,氢气失去电子,该反应为碱性溶液中正极反应,故D不合题意。
考点:考查燃料电池
点评:本题考查氢氧燃料电池及其工作原理,难度不大。在学习中应注意记忆其负正极的电极反应。
本题难度:一般
5、选择题 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是(?)
A.氢氧燃料电池的负极反应式:O2 + 2H2O+ 4e- = 4OH -
B.铅蓄电池充电时,标示“+”的接线柱连电源的正极,电极反应式为:PbSO4(S)-2e - + 2H2O(l)=PbO2(S) + 4H+(aq)+ SO42-(aq)
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e- = Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e - = Fe2+
参考答案:B
本题解析:A、燃料电池燃料在负极发生氧化反应,助燃剂如氧气在正极发生还原反应。氢氧燃料电池以氢氧化钾溶液为电解质时的正极反应式:O2 + 2H2O+ 4e- = 4OH -,错误;B、铅蓄电池充电时,标示“+”的接线柱连电源的正极,电极反应式为:PbSO4(S)-2e - + 2H2O(l)=PbO2(S) + 4H+(aq)+ SO42-(aq),正确;C、粗铜精炼时,与电源正极相连的是粗铜,电极反应式为:Cu-2e- = Cu2+,错误;D、钢铁发生电化学腐蚀的负极反应式:Fe-2e - = Fe2+,错误。
本题难度:简单