时间:2021-02-18 06:51:20
1、填空题 (8分)下面所列物质中,属于电解质的是__________(填序号,下同),属于非电解质的是________,属于强电解质的是__________,属于弱电解质的是________。
①CH3CH2OH ②CH3COOH ③熔融态KNO3 ④SO3 ⑤蔗糖? ⑥HF ⑦NaHCO3 ⑧氨水 ⑨Cl2 ⑩BaSO4 ?Cu
2、选择题 已知甲、乙、丙、丁四种溶液分别为CH3COONa、NH3?H2O、CH3COOH、Na2SO4中的一种,相同温度下,甲与乙两种溶液的pH相同,甲与丙两种溶液中的水的电离程度相同,则丙为( )
A.NH3?H2O
B.CH3COONa
C.CH3COOH
D.Na2SO4
3、选择题 下列物质的电离方程式,错误的是
A.HCl=H++Cl-
B.H2SO4=2H++SO42-
C.FeCl3=Fe3++Cl-
D.Ca(OH)2=Ca2++2OH-
4、填空题 纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.制备纳米TiO2的方法之一是TiCl4水解生成TiO2?xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用氧化还原滴定法测定TiO2的质量分数操作如下:首先在一定条件下,把TiO2溶解并转化为Ti3+,再用NH4Fe(SO4)2标准溶液滴定Ti3+至全部转化成Ti4+.
请回答下列问题: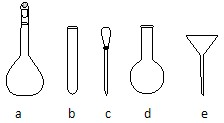
(1)TiCl4水解生成TiO2?xH2O的化学方程式为______.
(2)检验TiO2?xH2O中Cl-是否被除净的方法是______.
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是______;配制溶液使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要如图中的______(填字母代号).
(4)该滴定操作所用到的指示剂是______,滴定终点的现象是______
(5)滴定分析时,称取TiO2(摩尔质量为M?g?mol-1)试样w?g,消耗c?mol?L-1NH4Fe(SO4)2标准溶液V?mL,则TiO2质量分数为______.
5、选择题 下列关于“电解质”相关知识的叙述正确的是
[? ]