时间:2021-02-18 06:49:52
1、选择题 下列实验能达到预期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 取两只试管,分别加入4ml 0.01mol/L KMnO4酸性溶液,然后向一只试管中加入0.1mol/L H2C2O4溶液2ml,向另一只试管中加入0.1mol/L H2C2O4溶液4ml,记录褪色时间。 | 可以证明H2C2O4浓度越大反应速率越快。 |
| B | 向1ml 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀。 | 可以证明在相同温度下,溶解度Mg(OH)2>Fe(OH)3 |
| C | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大。 | 证明了非金属性S>C |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色会变浅。 | 可以证明Na2CO3溶液中存在水解平衡。 |
参考答案:D
本题解析:A、两只试管中草酸的浓度几乎是相同的,所以不能证明H2C2O4浓度越大反应速率越快,A不正确;B、由于氢氧化钠在和氯化镁溶液反应时氢氧化钠过量,所以再加入氯化铁时一定产生红褐色氢氧化铁沉淀,所以不能证明在相同温度下溶解度Mg(OH)2>Fe(OH)3,B不正确;S元素的最高价是+6价,因此应该测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,如果后者较大可以证明非金属性S>C,C不正确;D、向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色会变浅,这说明溶液中OH-浓度降低,这是由于碳酸钠与氯化钡反应生成了碳酸钡沉淀,从而抑制了CO32-的水解,溶液的碱性降低,D正确,答案选D。
本题难度:一般
2、选择题 下图为铜锌原电池示意图,下列说法不正确的是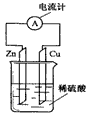
[? ]
A.反应物是锌和稀硫酸
B.铜片做阳极
C.电流计显示导线上电子由锌片流向铜片
D.该装置能将化学能转变为电能
参考答案:B
本题解析:
本题难度:一般
3、选择题 一种新型燃料电池,是用两根金属铂作电极插入KOH溶液中,然后向两极上分别通入H2和O2,下列说法不正确的是( )
A.通入H2的电极为负极
B.通入O2的一极电极反应为2H2O+O2+4e-4OH-
C.随着放电的进行,负极附近pH上升
D.标准状况下通入5.6LO2完全反应后有1mol电子转移
参考答案:A、氢氧燃料电池中通入氢气的一极为原电池的负极,故A正确;
B、氢氧燃料电池中通入氧气的一极为原电池的正极,发生还原反应,在碱性电解质环境下的电极反应为:2H2O+O2+4e-4OH-,故B正确;
C、碱性氢氧燃料电池中,电池的负极反应为2H2+2OH-=2H2O+2e-,因为消耗氢氧根离子,导致负极附近pH下降,故C错误;
D、氢氧燃料电池总反应为2H2+O2=2H2O,参加反应的氧气的物质的量是1mol时,转移电子是4mol,通入5.6L即0.25molO2完全反应后有1mol电子转移,故D正确.
故选C.
本题解析:
本题难度:简单
4、选择题 将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转。下列针对该装置的说法正确的是
A.将电能转化为化学能
B.电子由铜片流出
C.锌片是负极.
D.铜片逐渐被腐蚀
参考答案:C
本题解析:A、该装置是原电池,化学能转化为电能,A不正确;B、原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,锌比铜活泼,锌是负极,铜是正极,因此电子由锌片流出,B不正确;C、锌片是负极,C正确;D、铜是正极,被保护,锌被腐蚀,D不正确,答案选C。
本题难度:简单
5、填空题 (18分)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。? ’?
①已知25℃.10lkPa时:
2SO2(g)+O2(g)+2H2O(1)=2H2SO4(1)?△H = -457kJ·mol-l
SO3(g)+H2O(1)=H2SO4(1) △H= -130kJ·mol-l ?则反应2SO2(g)+O2(g)? 2SO3(g)的△H=?kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能?(填“增大”、“不变”或“减小”)。
?则反应2SO2(g)+O2(g)? 2SO3(g)的△H=?kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能?(填“增大”、“不变”或“减小”)。
②SO2水溶液可与SeO2反应得到硫酸,当有79gSe生成时,转移电子的物质的量为?mol,此反应的化学方程式是?。
(2)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO42-。电池放电时,负极的电极反应为:
V2+-e一=V3+。
①电池放电时的总反应方程式为?。
充电时,电极M应接电源的?极。
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+。则第一步反应过程中阴极区溶液n(H+)?(填“增大”、“不变”或“减小”),阳极的电极反应式为:?。
参考答案:(18分)
(1)①—197(2分)?减小(2分)
② 4(2分)? 2SO2+SeO2+2H2O=2H2SO4+Se(2分)
(2)①VO2++V2++2H+=VO2++V3++H2O(3分) 正极(2分)
②减小(2分) VO2++ H2O—e?= VO2++2H+(3分)
本题解析:(1)①根据盖斯定律,2SO2(g)+O2(g) 2SO3(g)的△H= -457kJ·mol-l—2×(-130kJ·mol-l)=—197 kJ·mol-l;使用催化剂,降低活化能,使反应速率加快。
2SO3(g)的△H= -457kJ·mol-l—2×(-130kJ·mol-l)=—197 kJ·mol-l;使用催化剂,降低活化能,使反应速率加快。
②Se元素由+4价降低为0,所以当有79gSe生成时,转移转移电子的物质的量为:79g÷79g/mol×4=4mol;根据氧化还原反应规律,SO2、SeO2、H2O反应生成H2SO4和Se,配平可得化学方程式:2SO2+SeO2+2H2O=2H2SO4+Se
(2)①根据电池结构图,正极上VO2+得电子生成VO2+,所以放电时的总反应方程式为:VO2++V2++2H+=VO2++V3++H2O;电极M为电池的正极,充电时应接电源的正极。
②第一步VO2+转化为V3+的电解方程式为:VO2++4H++2e?= V3++2H2O,消耗了H+,所以阴极区溶液n(H+)减小;阳极上VO2+失电子生成VO2+,所以电极方程式为:VO2++ H2O—e?= VO2++2H+。
本题难度:一般