时间:2021-02-18 06:49:10
1、填空题 利用如图所示的装置和其他必要的仪器用品,完成下列实验。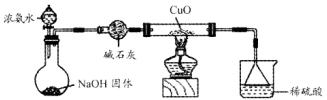
(1)证明氨气具有还原性。已知2NH3+3CuO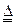 N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是?,稀硫酸的作用是?。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气??
?。
③证明NH3具有还原性的实验现象是?。
(2)用吸收了足量尾气的溶液制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:(NH4)2SO4+FeSO4+6H2O==(NH4)2 Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe外将转化为沉淀。
①吸收了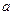 ?mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。?
?mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。?
?。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是?。
2、选择题 下列根据实验操作和现象所得出的结论正确的是(?)
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| B | 将少量某无色气体通入澄清石灰水 | 出现白色沉淀 | 该气体一定是CO2 |
| C | 分别用测定常温下0.1 mol·L--1 Na2SiO3和Na2CO3的PH | PH:Na2SiO3﹥Na2CO3 | 非金属性Si﹥C |
| D | 向浓度均为0.1 mol·L-1NaCl和NaI混合溶液中, 滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
3、实验题 喷泉是一种常见的自然现象,其产生原因是存在压强差。
制取氨气并完成喷泉实验(图中夹持装置已略去)。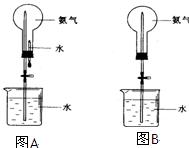
Ⅰ.①写出实验室制取氨气的化学方程式:__________________。收集氨气用_______法,要得到干燥的氨气可选用__________作干燥剂。
②.用图A装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是___________________。
如果观察不到“喷泉”或现象不明显,实验不成功的原因可能有:_________________;________________.
③.如果只提供图B的装置请说明引发喷泉的方法_____________
④比较图A和图B两套装置,从产生喷泉原理来分析,它们的不同点是:_______________
Ⅱ
喷泉实验装置设计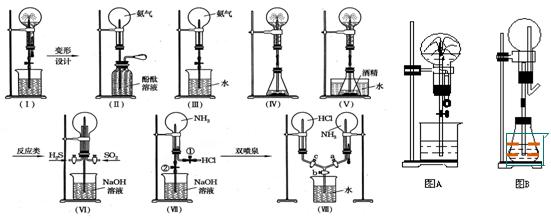
①.图A为化学教学中所用的喷泉实验装置,在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体,下列组合中前一物质表示干燥气体,后一液体表示胶头滴管及烧杯中的液体,其中能形成白色喷泉的是
A.氨和酚酞试液? B.氨和氯化铁溶液
C.HCl和AgNO3溶液? D.HCl和酚酞试液
②.图B为重新设计的喷泉装置。在图B的锥形瓶中分别加入足量如下物质,反应后可能产生喷泉的是
A.NaHSO4与NaOH溶液?B.NH4HCO3和稀盐酸
C.MnO2固体与浓盐酸?D.稀NH4Cl溶液与稀NaOH溶液
形成这种喷泉的反应条件是______________________
比较图A和图B两套装置,从产生喷泉原理来分析,它们的不同点是:____________________
在图B中锥形瓶外放一大烧杯,锥形瓶中加入酒精,大烧杯中加入冷水后,再加入足量下列物质,结果也产生了喷泉,大烧杯中加入的物质可
A.食盐?B.硝酸铵?C.浓硫酸?D.(NH4)2SO4
③在自然界和人类社会中,与上述图B装置原理相似的现象有:_______________________
Ⅲ.请用金属钠与水反应产生H2的反应设计一个喷泉装置。画出简易图不用文字叙述。
4、实验题 已知非金属单质硫是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: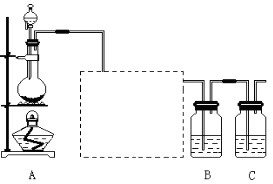
(1)装置A的分液漏斗中盛装的试剂是?,烧瓶中加入的试剂是?。
(2)画出虚线框内的实验装置图,并注明所加试剂,说明装置的作用?。
(3)装置B中盛放的试剂是?(选填下列所给试剂的代码),实验现象为?,反应的化学方程式为?。
A.Na2S溶液? B.Na2SO3溶液? C.Na2SO4溶液?
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)?。
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,该反应的离子方程式为?。
5、实验题 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验中模拟上述过程,其设计的模拟装置如下 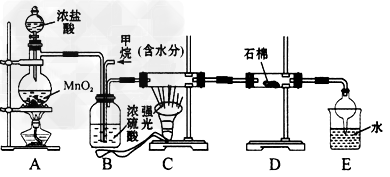
(1)B装置有三种功能:①________;②________;③________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值的取值范围为________。
(3)D装置的石棉中均匀混有KI粉末,其作用是_______________。
(4)E装置的作用是____和____(填编号)。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,置换出黑色小颗粒的化学方程一式为________________,可见有机反应有很多副反应。
(6)E装置除生成盐酸外,还含有机物,从E中分离出盐酸的最佳方法为____(填编号)。
A.萃取法B.蒸馏法C.过滤法D.分液法
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为____和____。(填编号)
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4