时间:2021-02-18 06:42:06
1、选择题 X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和甲乙化合物之间存在如图所示的关系。下列说法一定正确的是
A.X、Y、Z都是非金属单质
B.X、Y、Z中至少有一种是金属单质
C.若X、Y为金属单质,则Z必为非金属单质
D.若X、Y为非金属单质,则Z必为金属单质
参考答案:C
本题解析:根据题干分析X、Z,Y、Z均可以化合生成甲和乙,其中X可以置换出Y单质,由题意可知X、Y、Z可能是非金属单质;因为金属与金属不能直接化合,所以若X、Y为金属单质,则Z必为非金属单质,C项正确;若X、Y为非金属单质,则Z可能是为金属单质,也可能是非金属单质,A项、B项、D项错误。
点评:本题综合性较强,思维空间广,难度较大。在解此类题时,首先根据题中的物质的类别确定方程式的类别,然后再根据学过的物质确定反应物、生成物的范围,最后验证即可。
本题难度:困难
2、填空题 下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B,C,D,E是非金属单质,且在常温下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应.请回答下列问题:
(1)写出化学式:D______?F______?J______;
(2)写出F的电子式______;
(3)写出D和E的化学方程式:______
(4)写出化合物G和I的离子方程式:______.
参考答案:反应①是化工生产中的一种重要固氮反应,证明是氮气和氢气合成氨的反应,判断J为NH3,化合物I和J通常状况下呈气态,CD是非金属单质,依据反应条件是光照,推断为氢气和氯气生成氯化氢的反应,判断D为H2,E为N2,C为Cl2,I为HCl,J为NH3;化合物G的焰色反应为黄色说明含钠元素,G与HCl反应生成CO2,说明G为Na2CO3,气体单质B和A反应生成的F可以与二氧化碳反应生成碳酸钠和气体B单质,说明F中 含有钠元素,证明A为金属钠,推断B为O2,F为Na2O2;
(1)依据判断得到物质可知,D为H2,F为Na2O2,J为NH3,故答案为:H2;Na2O2;NH3;
(2)F为Na2O2;过氧化钠的电子式为:
,故答案为:
;
(3)D为H2,E为N2,反应的化学方程式为:N2+3H2催化剂.高温高压2NH3,故答案为:N2+3H2催化剂.高温高压2NH3 ;
(4)化合物G和I的离子方程式为:CO32-+2H+=CO2↑+H2O,故答案为:CO32-+2H+=CO2↑+H2O.
本题解析:
本题难度:简单
3、推断题 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。
请按要求回答下列问题:
(1)若B、C为两种氧化物气体,B转化为C时,颜色由无色变为红棕色,则A可能是_______或______。
(2)若A是一种常见的含有两个碳原子的有机物,且A和C反应生成一种有水果香味的物质。写出A与C生成水果香味的物质的反应方程式________________________。
(3)若A、B、C、D不仅满足上述转化关系,而且A和C在溶液中通过反应生成B。请回答下面三个问题:
①若D为强电解质、B为难溶于水的沉淀时,则A和C反应的离子方程式________________
符合条件的D物质可能是下列物质中的________(填序号)。
a.硫酸 b.醋酸 c.氢氧化钠 d.氨水 e.氯化钡 f.硝酸镁
②若D为非电解质时、B为难溶于水的沉淀时,则A和C反应的离子方程式是__________________。
③若C、D均为金属单质,向A溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则A和C反应的离子方程式是__________________,B溶液在储存时应加入少量的________。
参考答案:(1)N2;NH3(2) (3)①Al3++3AlO2-+6H2O==4Al(OH)3↓;ac;②Ca2++OH-+HCO3-==CaCO3↓+H2O;③Fe+2Fe3+==3Fe2+
(3)①Al3++3AlO2-+6H2O==4Al(OH)3↓;ac;②Ca2++OH-+HCO3-==CaCO3↓+H2O;③Fe+2Fe3+==3Fe2+
本题解析:
本题难度:一般
4、填空题 (15分)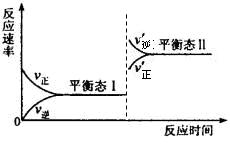
物质A、B、C有如下转化关系:
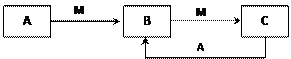 |
 6H2O+5N2。在一定条件下,该反应达到平衡态I后,升高温度平衡发生移动,达到平衡态II的反应速率随时间变化的关系图如右。该反应为? ?(填“吸热”或“放热”)反应;升高温度,该反应的平衡常数K值 (填“增大”、“减小”或“不变”)
6H2O+5N2。在一定条件下,该反应达到平衡态I后,升高温度平衡发生移动,达到平衡态II的反应速率随时间变化的关系图如右。该反应为? ?(填“吸热”或“放热”)反应;升高温度,该反应的平衡常数K值 (填“增大”、“减小”或“不变”)参考答案:(15分)
(1)NaOH溶液或盐酸(其他合理答案)?(2分)
(2)NaHCO3?(2分)
发酵粉,胃药等合理答案?(1分)
(3)2Fe2++Cl2=2Fe3++2Cl-?(3分)
(4)2H2S(g) +2SO2(g)=3S (g)+2H2O(l) △H=-(3a-b) /2 kJmol-1?(3分)
(5)放热?(2分)
减小?(2分)
本题解析:略
本题难度:一般
5、填空题 (9分)根据右图物质之间的转化关系,回答:
(1)写出A、B、C的化学式:
A___________;B___________;C___________。
(2)写出下列各步的化学反应方程式:
A→B:_____________________________________;
A→Cu:____________________________________。
B→C:_____________________________________。
参考答案:(1)CuSO4, Cu(OH)2, CuO(每空1分)(2) (每空2分)? CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
CuSO4 + Fe = FeSO4 + Cu? Cu(OH)2 ?CuO + H2O
?CuO + H2O
本题解析:根据转化图可知,A和铁反应生成铜,而C和稀硫酸反应生成A,所以A是硫酸铜。硫酸铜和氢氧化钠反应生成B,则B是氢氧化铜。氢氧化铜加热分解生成氧化铜,所以C是氧化铜。氧化铜倍氢气还原即生成铜单质。
本题难度:一般