时间:2021-02-18 06:37:31
1、选择题 25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>cCH3COO-)>c(OH-)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: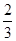 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):
2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
2、填空题 现有下列物质 ①NaCl晶体 ②液态SO2③纯醋酸④硫酸钡⑤铜⑥酒精(C2H5OH)⑦熔化的KCl ⑧NaOH溶液 请用以上物质回答下列问题。(填序号)
(1)属于强电解质且在上述状态下能导电的是_____________________;
(2)属于弱电解质的是_____________________________;
(3)属于非电解质,但溶于水后的水溶液能导电的是________________________。
今有a.盐酸 b.硫酸 c.醋酸三种酸,回答下列问题,(用酸的序号填写)
(4)在同体积、同pH的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是_________________;
(5)在同体积、同浓度的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是_________________;
(6)物质的量浓度均为0.1 mol·L-1的三种酸溶液的pH由大到小的顺序是___________。
3、选择题 高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数 
从以上表格中判断下列说法正确的是?
[? ]
A.在冰醋酸和水中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最弱的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4==2H++SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
4、选择题 室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
[? ]
A. 加水稀释2倍后,两溶液的pH均减小
B. 使温度都升高20℃后,两溶液的pH均不变
C. 加适量的醋酸钠晶体后,两溶液的pH均增大
D. 加足量的锌充分反应后,醋酸产生的氢气比盐酸少
5、选择题 在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH  ?CH3COO-+H+对于该平衡,下列叙述正确的是
?CH3COO-+H+对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动