时间:2021-02-18 06:33:37
1、选择题 设NA为阿伏加德罗常数,下列说法中正确的是
A.标准状况下,5.6 L四氯化碳含有的分子数为0.25NA
B.标准状况下,14 g氮气含有的核外电子数为5NA
C.1mol金属钠与氧气反应,不论生成氧化钠还是过氧化钠,转移电子数都是NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1 molH2时,转移的电子数为NA
参考答案:C
本题解析:标准状况下四氯化碳为液体,A项错误;14 g氮气含有1mol氮原子,共含有7mol核外电子,B项错误;氧化钠和过氧化钠中,钠的化合价都是+1价,C项正确;铝跟氢氧化钠溶液反应生成1 molH2时,转移的电子数为2NA,D项错误。
本题难度:简单
2、实验题 某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如下流程图:
可供选择的试剂:饱和Na2CO3溶液,饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液、KMnO4溶液(H+)、稀盐酸。
请根据流程图,回答相关问题:
(1)试剂a应该选用________。
(2)操作①②③④⑤的名称是________(填序号)。
A.萃取、过滤、分液、过滤、蒸发结晶
B.萃取、分液、蒸馏、过滤、蒸发结晶
C.分液、萃取、过滤、过滤、蒸发结晶
D.萃取、分液、分液、过滤、蒸发结晶
(3)除去无色液体Ⅰ中的Ca2+、Mg2+、SO42-,选出试剂b(试剂b代表一组试剂)所代表的试剂,按滴加顺序依次是______________________(填化学式)。
(4)调节pH的作用是________,操作方法是_____________________________________
________________________________________________________________________。
(5)操作⑤中用到的瓷质仪器名称是__________________________________________。
参考答案:(1)H2O2溶液
(2)B
(3)BaCl2溶液、饱和K2CO3溶液、KOH溶液(或KOH溶液、BaCl2溶液、饱和K2CO3溶液或BaCl2溶液、KOH溶液、饱和K2CO3溶液)
(4)除去过量的OH-及CO32- 滴加稀盐酸,无气体产生时,用pH试纸测定至pH=7
(5)蒸发皿
本题解析:(1)由加入的CCl4及得到的深红棕色液体知,试剂a能将Br-氧化为Br2,试剂a应具有氧化性,所以应选用H2O2溶液。
(2)由流程图知,无色液体Ⅰ中含有K+、Cl-、Ca2+、Mg2+、SO42-,无色液体Ⅲ中只含有K+、Cl-,则试剂b的作用是除去Ca2+、Mg2+、SO42-。操作①是萃取,操作②是将互不相溶的两种液体分开——分液,操作③是将沸点不同的、互溶的两液体分开——蒸馏,操作④是将溶液与沉淀分开——过滤,操作⑤是将KCl从其水溶液中提取出来——结晶。
(3)由于除杂时除杂试剂需过量,且不能引入新杂质,所以除去Ca2+,选用饱和K2CO3溶液;除去Mg2+,选用KOH溶液;除去SO42-,选用BaCl2溶液。而且只要满足BaCl2溶液在饱和K2CO3溶液之前加入即可。
(4)由以上知,无色液体Ⅱ中还含有杂质离子CO32-和OH-,需用盐酸来除去过量的OH-及CO32-,调节pH=7的操作方法是滴加盐酸,无气体产生时,用pH试纸测定至pH=7。
(5)由于操作⑤是蒸发结晶,所以该操作用到的瓷质仪器是蒸发皿。
本题难度:一般
3、填空题 (6分)对一份稀溶液作初步分析发现,溶液无色、澄清,其中可能含有SO42—、Na+、CO32— 、H+、Cl—等离子中的若干种。然后又做了如下实验,以确认这些离子是否大量存在。
(1)用pH试纸测溶液的pH值,试纸显红色;
(2)取 2mL上述溶液,加入足量硝酸钡溶液,结果生成了不溶于稀硝酸的白色沉淀;
2mL上述溶液,加入足量硝酸钡溶液,结果生成了不溶于稀硝酸的白色沉淀;
(3)取(2)中的上层清液,加入硝酸银溶液,结果又生成了不溶于稀硝酸的白色沉淀。
问:上述实验可以确定溶液中一定含有?离子,一定没有?离子。
设计实验方案检验不能确定的其他离子。
_____ ____________________________________________________________________
_________________________________________________________________________
参考答案:一定含有H+、SO42-、Cl-离子,一定没有CO32-离子。
用洁净的铂丝蘸取原溶液进行焰色反应实验,如果看到火焰呈黄色,则原溶液中有Na+。
(每空2分)
本题解析:略
本题难度:一般
4、实验题 取m1g某常见粉末(由M、Z两种元素组成)进行如下实验。将该粉末和足量碳粉充分混合,平铺在反应管a中,b瓶中盛足量澄清石灰水。按图连接仪器并检查好气密性。
实验开始时,先进行操作G,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成。同时,b瓶的溶液中出现白色浑浊。经一系列测定,确定反应完全后,停止加热,继续通氮气,直到反应管冷却。此时,管中的熔融物凝固成银白色金属M,再进行分离、提纯、称量,得到m2g纯金属M,且m1=1.38m2。根据以上叙述回答问题:
(1)该粉末的化学式是_________ ____;操作G是______________________。
____;操作G是______________________。
(2)停止加热前是否需要先关闭止水夹K?_________;原因:_____________。
(3)反应管a中产生金属单质的化学方程式为:__________________________。 (4)本实验的尾气是否需处理?_______;如需处理,请回答如何处理;如不需处理,
(4)本实验的尾气是否需处理?_______;如需处理,请回答如何处理;如不需处理,
请说明理由。_______________________________________________。
(5)在题目“一系列测定”中,当连续_____________时,则可确定反应管中反应已完全。
(6)某同学做该实验时,b瓶最终得到了澄清溶液,他向该溶液中加入了某物质,溶液又出现了浑浊。请书写出现浑浊的离子方程式:___________________________。
参考答案:(11分)
(1)Fe3O4;缓缓通入氮气(2分)
(2)不需要。因为停止加热后仍继续通N2,不会发生倒吸。(2分)
(3) Fe3O4+4C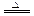 3Fe+4CO↑,或F
3Fe+4CO↑,或F e3O4+2C
e3O4+2C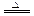 3Fe+2CO2↑,
3Fe+2CO2↑,
或Fe3O4+4CO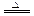 3Fe+4CO2↑?(1分)
3Fe+4CO2↑?(1分)
(4)需要处理,因为生成了有毒的CO。?(1分)
可连接一个加热的装有CuO粉末的反应管(或放一个点燃的酒精灯,或用一气球收集气体。其它合理答案同样给分)。(1 分)
分)
(5)两次称量反应管及反应混合物总质量的差值不超过0.001g。(2分)
(6)Ca2++HCO3—+OH—→CaCO3↓+H2O(2分)(其他合理答案也给分)如加Ba(OH)2
本题解析:略
本题难度:一般
5、填空题 (8分)请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及分离方法的编号填入表中。
试 剂:a.水? b.NaOH溶液? c.溴水? d.饱和Na2CO3溶液? e.新制CaO
分离方法:①分液?②过滤?③洗气?④蒸馏
| 混合物 | 需加入的试剂 | 分离方法 |
| 溴苯(溴) | ? | ? |
| 乙烷(乙烯) | ? | ? |
| 乙醇(水) | ? | ? |
| 乙酸乙酯(乙酸) | ? | ? 参考答案: 本题解析:略 本题难度:简单 |