时间:2021-02-18 06:30:28
1、填空题 电解法促进橄榄石(主要成分是Mg2SiO4)固定CO2的部分工艺流程如下:
已知:Mg2SiO4(s) +4HCl(aq)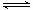 2MgCl2(aq) +SiO2 (s) + 2H2O(l)?△H =-49.04 kJ·mol-1
2MgCl2(aq) +SiO2 (s) + 2H2O(l)?△H =-49.04 kJ·mol-1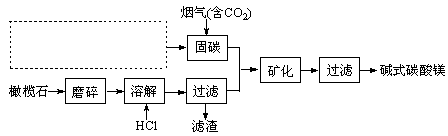
(1)某橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为?。
(2)固碳时主要反应的方程式为NaOH(aq)+CO2 (g)=NaHCO3 (aq),该反应能自发进行的原因是?。
(3)请在上图虚框内补充一步工业生产流程?。
(4)下列物质中也可用作“固碳”的是?。(填字母)
a.CaCl2? b.H2NCH2COONa? c.(NH4)2CO3
(5)由图可知,90℃后曲线A溶解效率下降,分析其原因?。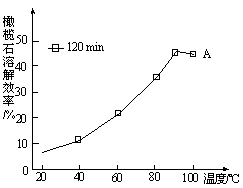
(6)经分析,所得碱式碳酸镁产品中含有少量NaCl和Fe2O3。为提纯,可采取的措施依次为:对溶解后所得溶液进行除铁处理、对产品进行洗涤处理。判断产品洗净的操作是?。
参考答案:(1)9MgO·FeO·5SiO2?(2)ΔH<0
(3)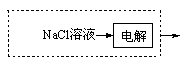 或
或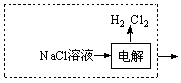
(4)bc
(5)120min后,溶解达到平衡,而反应放热,升温平衡逆向移动,溶解效率降低。
(6)取少量最后一次的洗涤液,加硝酸酸化的硝酸银溶液,如无沉淀产生,则已洗净。
本题解析:(1)用氧化物形式表示硅酸盐。硅酸盐中含金属元素、Si、O,有的还有结晶水,规则是先写金属氧化物,在写SiO2,要是有水,H2O写在最后。要是有多种金属元素,则按金属活动顺序表,活泼金属氧化物在前,不活泼金属氧化物在后。橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为9MgO·FeO·5SiO2。(2)能自发进行的反应有两个趋势,一是正反应是放热反应,另一是混乱度向增大方向。NaOH(aq)+CO2 (g)=NaHCO3 (aq),该反应是混乱度减小,不利用自发,要自发只能是正反应是放热反应。即ΔH<0 。(3)从固碳的反应可以看出需要用到氢氧化钠溶液,所以图虚框内补充得到氢氧化钠一步工业生产流程即可,可能通过电解饱和的氯化钠溶液,可以写为 或
或
。(4)a.CaCl2不会与二氧化碳反应; b.H2NCH2COONa 是氨基酸,氨基能与酸反应生成盐,能固碳。 c.(NH4)2CO3溶液能与二氧化碳反应,生成碳酸氢铵。故选bc。(5)由图可知,120min后,溶解达到平衡,而反应放热,升温平衡逆向移动,溶解效率降低。(6)新产品若没有洗净,可能有Cl-,判断产品洗净的操作是可以通过检验氯离子即可,方法是取少量最后一次的洗涤液,加硝酸酸化的硝酸银溶液,如无沉淀产生,则已洗净。
本题难度:一般
2、选择题 化学与科学、技术、社会及生自学成才密切相关。下列做法或说法不正确的是
[? ]
A.研发高效低毒的农药,降低作物的农药残留量
B.用可降解的无毒聚乳酸塑料代替聚乙烯作食品包装袋,以防止白色污染
C.驾驶家用汽车代替公交车参观世博园,以便节能减排
D.对干旱地区,适时在云层播散化学物质,实施人工降雨,以缓解旱情
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列关于化工生产原理的叙述错误的是( )。
①可以用电解熔融氯化钠的方法来制取金属钠
②可以用钠加入氯化镁饱和溶液中制取镁
③可电解冶炼铝,原料是氯化铝
④炼铁高炉中所发生的反应都是放热的,故无需加热
A.①②
B.②③
C.①②③
D.②③④
参考答案:D
本题解析:金属的冶炼方法较多,K—Al用电解法,Zn—Cu热还原法,Hg—Ag热分解法,Pt、Au富集法,AlCl3是共价分子构成的,熔融状态不能电解得到Al。
本题难度:简单
4、填空题 (14分) 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺: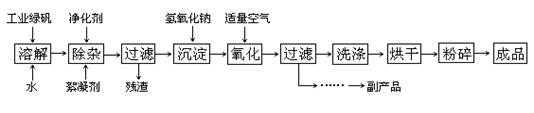
已知:①工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
②? Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O?
③? 12.16﹡1000﹡52.5%=6384,6384/152=42请回答下列问题:
(1)铁的常见氧化物有?;
(2)Fe3O4与稀硝酸反应的离子方程式是?,检验反应后的溶液中含Fe3+的方法?;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:?;
(4)生产中可获得的副产品是?,提取该副产品的操作顺序是?(填写序号)
a.过滤? b.加热浓缩? c.冷却? d.结晶? e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为?L/h(假设反应在标准状态下进行,空气中O2占20%)。
参考答案:(1)FeO、Fe2O3、Fe3O4?(3分)
(2)3Fe3O4 + 28H++NO3-=9Fe3++NO↑+14H2O? (2分)?取待测液少许于试管中,加入适量的KSCN溶液,若溶液显血红色,则证明含Fe3+ (2分)
(3)4Fe(OH)2+2H2O+O2=4Fe(OH)3 (2分)
(4)Na2SO4·10H2O(或芒硝,写Na2SO4也可) (1分)?bcdae? (2分)
(5)784 (2分)
本题解析:(1)铁的主要化合价是+2价和+3价,所以常见氧化物是FeO、Fe2O3、Fe3O4。
(2)硝酸具有强氧化性,Fe3O4中含有亚铁离子,所以二者发生氧化还原反应,生成硝酸铁和NO及水。检验铁离子一般用KSCN溶液,现象是溶液显血红色。
(3)氢氧化亚铁具有还原性,极易被氧化生成氢氧化铁。
(4)根据转化示意图和原子守恒可判断,副产物是硫酸钠。要使溶液中的硫酸钠析出,需要加热浓缩,然后利用溶解度随温度的变化通过冷却结晶,即得到硫酸钠晶体,过滤洗涤即可。
(5)要使产品较纯,则氧气和氢氧化亚铁要恰好反应。根据题意可知,每小时通过的硫酸亚铁是42mol。根据Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O可知,氢氧化亚铁和氢氧化铁的物质的量之比是1︰2的,所以需要氧化氢氧化亚铁是28mol,则消耗氧气是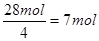 。所以通过的空气是7mol×5×22.4L/mol=784L。
。所以通过的空气是7mol×5×22.4L/mol=784L。
本题难度:一般
5、填空题 最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下
(1)上述流程中碳酸钾溶液所起的作用是_________________;
(2)分解池中反应的化学方程式为_________________;
(3)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出4947 kJ的热量,试写出合成塔中发生反应的热化学方程式_________________;
(4)从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用300℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是_________________;
(5)下图是甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O 则: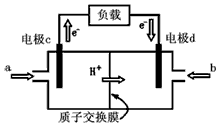
a处通进的物质是________(写名称);电极d的名称是______极;电极c处发生的电极反应方程为:
_________________。
参考答案:(1)富集空气中的CO2,为合成甲醇提供CO2(其余合理答案均给分)
(2)2KHCO3 K2CO3+CO2↑+H2O
K2CO3+CO2↑+H2O
(3)CO2(g)+3H2(g)==CH3OH(g)+H2O(g);ΔH=-49.47kJ/mol
(4)保证有较快的反应速率,提高产率(能答出与速率相关的正确答案即可)
(5)甲醇;正;CH3OH+H2O-6e-=CO2+6H+
本题解析:
本题难度:一般