时间:2021-02-18 06:29:46
1、填空题 (10分)质量为34 g的NH3其物质的量是?mol,在标准状况下的体积约为?L 。0.1 mol H2S中有约?个氢原子;相同质量的NH3和H2S中分子个数比为?。配制100 mL浓度为1 mol·L-1的稀硫酸,需要用98%密度为1.84 g/cm3的浓硫酸?mL。
2、选择题 如果2g甲烷含有的分子数为a个,则22g二氧化碳的分子数为
A.a个
B.0.5a个
C.2a个
D.4a个
3、计算题 欲将0.10 mol/L的NaOH溶液和0.60 mol/L的NaOH溶液混合成0.20 mol/L的NaOH溶液。求两种溶液的体积比(忽略混合时体积变化)。
4、选择题 设NA为阿伏加德罗常数,下列叙述正确的是
A.27g铝的原子最外层电子总数为NA
B.2.8 g N2和2.8 g CO所含电子数均为1.4NA
C.1L0.1mol·L-1乙酸溶液中H+数为0.1NA
D.标准状况下,22.4L乙醇的分子数为NA
5、选择题 分别取两份a L含(NH4)2SO4和NH4NO3的混合液,一份用b mol NaOH并加热刚好把NH3全部赶出,另一份与BaCl2溶液完全反应,消耗c mol BaCl2。则原溶液中NO3-的物质的量浓度(单位mol·L-1)为
A.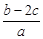
B.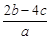
C.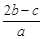
D.