时间:2021-02-18 06:27:34
1、选择题 下列叙述正确的是
A.CH4的摩尔质量是16g
B.物质的量是表示含有一定数目粒子集合体的物理量
C.从100mL0.1mol/L盐酸中取出10mL,溶液密度不变
D.4.4gCO2含有0.1mol粒子
参考答案:BC
本题解析:A、摩尔质量的单位是g/mol,A错误;B、物质的量是一个物理量,用于表示含有一定数目粒子集合体,B正确;C、溶液是均一稳定的,与所取的溶液的体积无关,C正确;D、分子、离子、原子、电子、质子、中子等均为粒子,故本题中粒子所指是什么不明确,D错误。答案选BC。
考点:考查摩尔质量、物质的量的相关计算。
本题难度:一般
2、简答题 某同学用10mol/L的浓盐酸配制250mL?1mol/L的稀盐酸,并进行有关实验.请回答下列问题:
(1)需要量取浓盐酸______mL.
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有______、______等.
(3)取所配制的稀盐酸100mL,与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为______g,设反应后溶液的体积仍为100mL,则反应后溶液中H+的物质的量浓度为______.
参考答案:(1)设浓盐酸的体积为V,则10mol×V=1mol/L×0.25L,V=0.025L=25mL,故答案为:25;
(2)用胶头滴管定容,用250mL容量瓶配制溶液,故答案为:胶头滴管;250mL容量瓶;
(3)盐酸和锌反应的方程式为:Zn+2HCl=ZnCl2+H2↑,设参加反应的锌的质量为x,参加反应的盐酸的物质的量为y.
? Zn+2HCl=ZnCl2+H2↑
65g?2mol?22.4L
x?y?0.896L
x=0.896L×65g22.4L=2.6g
y=2mol×0.896L22.4L=0.08mol,
剩余盐酸的物质的量=1mol/L×0.1l-0.08mol=0.02mol,
则氢离子浓度=0.02mol0.1L=0.2mol/L,
故答案为:2.6;0.2mol/L.
本题解析:
本题难度:一般
3、选择题 如果1g水中含有n个氢原子,则阿伏加德罗常数是( )
A.1/n mol-1
B.9n mol-1
C.2nmol-1
D.nmol-1
参考答案:B
本题解析:根据m/M=n=N/NA 得到(1/18)x2=n/NA NA="9n" mol-1
考点:考查阿伏伽德罗常数。
本题难度:一般
4、选择题 关于1mol·1-1的Na2SO4溶液的叙述正确的是
A.溶液中含1molNa2SO4[
B.Na+的浓度为1mol·1-1
C.配制时,将1molNa2SO4溶于1L水中
D.将322gNa2SO4·10H2O溶于少量水后再稀释成1000mL,即配制成相应溶液
参考答案:D
本题解析:A错,无溶液体积无法计算物质的量;B错,Na+的浓度为2mol·1-1;C错,溶剂的体积为1L而不是溶液的体积是1L,所以无法计算;D正确;
本题难度:简单
5、选择题
A.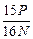 ×100%
×100%
B.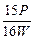 ×100%
×100%
C.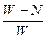 ×100%
×100%
D.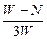 ×100%
×100%
参考答案:B
本题解析:由反应关系式:FeS2~2SO2,假设FeS2x g,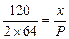 ,x=
,x=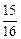 P,FeS2质量分数为
P,FeS2质量分数为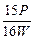 ×100%。
×100%。
本题难度:简单