时间:2021-02-18 06:27:34
1、选择题 下列溶液中的氯离子浓度与50mL?1mol/L的AlCl3溶液中氯离子浓度相等的是( )
A.150mL1mol/L的NaCl
B.75mL3mol/L的NH4Cl
C.150mL2mol/L的KCl
D.75mL2mol/L的CaCl2
参考答案:50mL1mol/L的AlCl3溶液中的Cl-浓度为3mol/L.
A、150ml1mol/L的NaCl溶液中Cl-浓度为1mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度不相等,故A不符合;
B、75mL3mol/L的NH4Cl溶液中Cl-浓度为3mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度相等,故B符合;
C、150mL2mol/L的KCl溶液中Cl-浓度为2mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度不相等,故C不符合;
D、75ml2mol/L的CaCl2溶液中Cl-浓度为4mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度不相等,故D不符合.
故选:B.
本题解析:
本题难度:一般
2、选择题 在两个容积相同的容器中,一个盛有NH3,另一个盛有N2、H2的混合气体,在同温同压下,两容器内的气体一定具有相同的
A.原子数
B.分子数
C.质量
D.密度
参考答案:B
本题解析:同温同压下,气体摩尔体积相等,相同体积的不同气体的物质的量相等、分子数相等,A、两个容器中每个分子所含原子个数不等,所以相同分子数的这两个容器中原子个数不等,A错误;B、同温同压下,气体摩尔体积相等,相同体积的不同气体的物质的量相等、分子数相等,B正确;C、两个容器中气体平均摩尔质量不一定相等,根据m=nM知其质量不一定相等,C错误;D、根据ρ=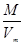 知,两个容器中气体平均摩尔质量不一定相等,所以其密度不一定相等,D错误;答案选B。
知,两个容器中气体平均摩尔质量不一定相等,所以其密度不一定相等,D错误;答案选B。
考点:考查阿伏加德罗定律的应用。
本题难度:一般
3、选择题 实验室配制1? mol·L-1盐酸250 mL,下列必须用到的仪器是(? )
A.250 mL容量瓶
B.托盘天平
C.500 mL烧杯
D.酒精灯
参考答案:A
本题解析:用浓HCl配稀HCl,不需称量和加热,故B、D项不选。可用100 mL或200 mL烧杯,不必用500 mL烧杯。
本题难度:简单
4、填空题 已知一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)原NaOH溶液的质量分数为?;
(2)所得溶液中Cl-的物质的量为?mol;
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=?。
参考答案:(1)10.7%。?(2)0.25。?(3)3︰2。
本题解析:(1)n(NaOH)=0.1L×3.00 mol/L=0.3mol。m(NaOH)= 0.3mol×40g/mol=12g.m(溶液)=ρ·V=1.12 g/mL×100 mL=112g.所以原NaOH溶液的质量分数为12g÷112g×100%=10.7%。(2)在反应后的溶液中Na元素的存在方式为NaCl、NaClO。根据Na、Cl元素守恒可得所得溶液中Cl-的物质的量为0.3mol-0.0500 mol=0.25mol.(3)由方程式 NaOH+HCl=NaCl+H2O ;Cl2+2NaOH=NaCl+NaClO+H2O.可知与NaOH反应消耗的氯气的物质的量为0.0500 mol,同时产生NaCl0.0500 mol。则HCl反应产生的NaCl的物质的量为0.25mol-0.0500 mol=0.20mol.因此发生反应H2+Cl2 2HCl的H2与Cl2的物质的量都为0.10mol.所以n(H2)=0.1mol;n(Cl2)(总)= 0.1mol+0.0500 mol=0.15mol.故所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=0.15mol:0.1mol=3:2。
2HCl的H2与Cl2的物质的量都为0.10mol.所以n(H2)=0.1mol;n(Cl2)(总)= 0.1mol+0.0500 mol=0.15mol.故所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=0.15mol:0.1mol=3:2。
本题难度:一般
5、填空题 (2分)把1120 mL(标准状况时的体积)氯化氢溶解于水,配制成500 mL溶液,该溶液的氢离子浓度为?mol / L,溶液的pH值为?。
参考答案:0.1;? 1
本题解析:略
本题难度:简单